作者简介:周俊良(1980—),副研究员,从事农产品贮藏与加工研究工作,E-mail:gsszjl2008@163.com。
以紫红龙火龙果果皮为原料,比较溶剂浸取法和超声波辅助提取果皮色素的效率高低。确认溶剂法的最佳条件为乙醇浓度40%、pH值为4、提取温度为30 ℃、料液比为1:8,振荡30 min火龙果果皮红色素的提取得率为7.36%;超声波辅助法的最佳条件为乙醇浓度40%、微波功率300 W、pH值为4、提取温度为30 ℃、料液比为1:8、提取时间为15 min,火龙果果皮红色素的提取得率为7.78%。根据2种方法的比较,超声波辅助提取法具有提取时间短、提取溶剂用量少、提取效率高的优点,因而选择超声波辅助提取法作为紫红龙火龙果果皮红色素的提取方法。
火龙果(Pitaya)本名青龙果、红龙果, 因其外表肉质鳞片似蛟龙外鳞而得名。因食火龙果健康长寿, 俗名叫长寿果[1]。火龙果由南洋引入台湾种植, 再由台湾改良引进, 现在主要分布在我国海南省及大陆南部、广西、广东等地。到2015年, 贵州省火龙果种植面积达到2万hm2, 成为中国最大的火龙果标准化生产基地。由贵州省果树科学研究所自主选育出的抗寒火龙果新品种紫红龙, 目前成为贵州省部分区域的火龙果主栽品种。
火龙果具有美容保健双重功效。火龙果富含天然红色素, 从皮到肉的颜色呈玫瑰红到紫红色, 是天然色素提取加工的良好来源[2]。目前, 色素提取方法有水蒸气蒸馆法、化学溶剂法、油脂分离法(脂吸法)、冷冻压缩法(压榨法)、CO2萃取法和超声波提取法等。其中, 油脂分离法、CO2萃取法均较昂贵, 而冷冻压榨法则适用于果皮部分的精油提取, 水蒸气蒸馆法虽成本低但得率不高, 故而化学溶剂法和超声波提取法是目前普遍采用的提取方法[3, 4, 5, 6]。我国内陆地区火龙果的消费主要还是集中在生食阶段, 大量火龙果果皮都当作生活废料丢弃, 造成了资源的浪费和环境污染。因此, 对火龙果果皮的再次利用, 即可以有利于火龙果的综合利用, 又可以增加果农的收益。本文在已有研究基础上对这两种方法进行优化并比较分析, 对火龙果红色素的提取方法具有一定的借鉴意义, 也为火龙果色素提取方法的改良和工业化生产奠定基础。
火龙果品种紫火龙采于贵州省果树科学研究所资源圃(罗甸县)。甜菜苷红色素标准品(上海嘉汇精细化工有限公司, 纯度≥ 99%); 盐酸、氧氧化钠、丙酮、无水乙醇(国药集团化学试剂有限公司, 分析纯)。721型分光光度计(上海第三分析仪器厂); KQ-300型三频数控超声清洗器(昆山市超声仪器有限公司); jBS-210S电子天平(北京赛多利斯天平有限公司); TG16-WS 台式高速离心机(湘仪离心机仪器有限公司); BS-W201恒温水浴锅(上海贝凯生物化工设备有限公司); GZX-9140MBE型数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂); RE-52AA型旋转蒸发器(上海亚荣生化仪器厂); BS224S型电子天平(北京赛多利斯仪器系统有限公司); 雷磁PHS-3C酸度计(上海精密科学仪器厂); KQ-250DB超声波发生器(昆山超声仪器有限公司); AnkiTDL-4离心器(上海安亭科学仪器); DSHZ-300型多用途恒温水浴振荡器(江苏太仓市实验设备厂); DZ-2BCⅡ 型真空干燥箱(天津泰斯特仪器有限公司)。
1.2.1 原材料的处理
选用新鲜火龙果果皮, 除去杂质, 用水洗净, 切成小块, 70 ℃烘干, 用粉碎机粉碎后过60目筛, 于干燥通风处避光保存。
1.2.2 火龙果果皮红色素的提取
不同浸提剂的影响。称取火龙果果皮粉0.500 0 g于小烧杯中, 分别加入蒸馏水、50%无水乙醇、50%的丙酮、50%的甲醇各50 mL, 常温下振荡提取60 min, 离心并收集上清, 过滤, 用相应的提取溶剂定容至50 mL, 以提取溶剂作参比, 在536 nm下用1 cm比色皿测其吸光度。
不同浸提剂的影响。称取火龙果果皮粉0.500 0 g于小烧杯中, 分别加入20%、40%、60%、80%、100%乙醇各50 mL, 常温下振荡提取60 min, 离心并收集上清, 过滤, 用相应的提取溶剂定容至50 mL, 以提取溶剂作参比, 在536 nm下用1 cm比色皿测其吸光度。
不同pH值浓度的影响。称取火龙果果皮粉0.500 0 g于小烧杯中, 分别加入pH值为2、3、4、5、6、7、8的40%酸化乙醇各50 mL, 常温下振荡提取60 min, 离心并收集上清, 过滤, 用相应的提取溶剂定容至50 mL, 以提取溶剂作参比, 在536 nm下用1 cm比色皿测其吸光度。
不同浸提温度的影响。称取火龙果果皮粉0.500 0 g于小烧杯中, 加入40%的乙醇50 mL, 在30 ℃、45 ℃、60 ℃、75 ℃、80 ℃下振荡60 min, 离心收集上清, 过滤, 用相应的提取溶剂定容至50 mL, 以提取溶剂作参比, 在536 nm下用1 cm比色皿测其吸光度。
不同浸提时间的影响。称取火龙果果皮粉0.500 0 g于小烧杯中, 加入40%的乙醇50 mL, 在常温下振荡15、30、45、60、75和90 min, 离心收集上清, 过滤, 用相应的提取溶剂定容至50 mL, 以提取溶剂作参比, 在536 nm下用1 cm比色皿测其吸光度。
不同料液比的影响。称取火龙果果皮粉0.500 0 g于小烧杯中, 加40%乙醇50 mL, 加入料液比为1:2、1:4、1:6、1:8、1:10、1:12, 在常温下振荡60 min, 离心收集上清, 过滤, 用相应的提取溶剂定容至50 mL, 以提取溶剂作参比, 在536 nm下用1 cm比色皿测其吸光度。
不同超声波功率的影响。称取火龙果果皮粉0.500 0 g于小烧杯中, 加入40%的乙醇50 mL, 在常温下分别采用100、200、300、400、500、600 W的超声波提取功率, 提取20 min后, 离心收集上清, 过滤, 用相应的提取溶剂定容至50 mL, 以提取溶剂作参比, 在536 nm下用1 cm比色皿测其吸光度。
1.2.3 标准曲线的测定
称取甜菜苷红色素标准品0.1000 g, 用pH 3.0缓冲液溶解定容到1 L, 混合均匀得终浓度为0.10 mg· mL-1的标准品储备液。然后分别移取4、8、12、16、20 mL标准品储备液至100 mL容量瓶中, 加缓冲液定容后于536 nm处, 测其吸光度。最后分别以溶液浓度和吸光度为横坐标和纵坐标, 绘制甜菜苷红色素标准曲线(图1)。
得其回归方程为y=0.01x-0.001 2, R2=0.999 9。甜菜苷红色素标准溶液浓度在0~20 μ g· mL-1范围内线性关系良好。
常温下分别采用水、50%无水乙醇、50%的丙酮、50%的甲醇作为浸提剂进行色素提取, 考察不同溶剂对火龙果果皮红色素提取率的影响, 每种处理各作3个独立的生物学重复, 分别取平均值进行比较分析。
图2显示, 不同浸提剂对火龙果果皮红色素提取率存在明显影响, 有机溶剂乙醇、丙酮和甲醇提取效果明显优于蒸馏水, 其中50%无水乙醇和50%甲醇的提取效果最佳, 其次为50%的丙酮。生产上考虑到甲醇为有毒性的有机溶剂, 因此推荐使用乙醇作为浸提剂。
考虑到乙醇溶剂为最佳的浸提剂, 在常温下分别设置20%、40%、60%、80%、100%乙醇, 各取50 mL, 考察不同乙醇浓度对火龙果果皮红色素提取率的影响。每处理各作3个独立的生物学重复, 分别取平均值进行比较分析。
由图3可知, 随着乙醇浓度的增加, 溶液的吸光值增大, 乙醇浓度为40%时达到最大值; 当乙醇浓度大于40%时, 溶液的吸光值与乙醇浓度呈反比; 乙醇浓度为80%时, 溶液的吸光值达到最低点; 乙醇浓度大于80%时, 溶液的吸光值与浓度又呈现出正比关系; 但乙醇为100%时, 溶液的吸光值也远低于乙醇浓度为40%时的溶液吸光值。据此推测, 乙醇浓度为40%时为最佳提取浓度值。
考虑到浸提液不同的酸碱性可能对火龙果果皮红色素提取效果存在影响, 设置pH值分别为2、3、4、5、6、7、8的40%酸化乙醇, 各取50 mL, 常温下振荡提取60 min, 提取火龙果果皮红色素。根据吸光值的大小考察不同pH值对火龙果果皮红色素提取率的影响, 每处理各作3个独立的生物学重复, 分别取平均值进行比较分析。
图4显示, 当pH值在3~7时, 溶液的吸光值都较稳定, 其中pH为4时, 吸光值达到最大值; 当pH> 7时, 溶液吸光值呈急剧下降趋势。据此推测, 火龙果果皮红色素在酸性条件下较为稳定, 在碱性条件下不稳定。因此, 选择在酸性条件下提取火龙果红色素为佳, 其中pH值4时可达最佳提取效果。
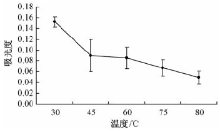
考虑温度对火龙果红色素提取效果的影响, 设置40%的乙醇提取液在30 ℃、45 ℃、60 ℃、75 ℃、80 ℃下振荡60 min, 离心收集上清, 过滤, 检测其提取液的吸光值, 每处理各作3个独立的生物学重复, 分别取平均值进行比较分析。图5显示, 随着温度逐步增加, 溶液吸光值逐渐降低。温度为30 ℃时, 溶液吸光值最大。据此推测, 随着提取温度的升高, 火龙果果皮红色素可能出现降解现象, 高温影响其稳定性。30 ℃为最佳提取温度。
考虑到浸提时间可能对火龙果果皮红色素提取效果不同, 试验研究在常温下以40%乙醇为浸提液加入50 mL, 分别设置振荡15、30、45、60、75和90 min, 离心收集上清、过滤, 检测其提取液的吸光值。每处理各作3个独立的生物学重复, 分别取平均值进行比较分析。
由图6可知, 浸提时间对火龙果果皮红色素提取的效果影响不明显。说明延长浸提时间对果皮红色素提取得率无意义。因此, 选取30 min作为火龙果果皮红色素的最佳提取时间。
为分析不同料液比对火龙果果皮红色素提取效果的影响, 在常温下以40%的乙醇为浸提液, 设置料液比分别为1:2、1:4、1:6、1:8、1:10、1:12, 离心收集上清、过滤, 检测其提取液的吸光值, 并计算出各个处理的红色素得率, 据此比较各处理的效果。每处理各作3个独立的生物学重复, 分别取平均值进行比较分析。
图7显示, 当料液比逐渐增大时, 红色素得率也增步增加; 当料液比大于1:8时, 红色素得率呈逐步下降的趋势。据此推测, 料液比1:8为最优提取条件。
采用40%乙醇作为提取溶剂, 在提取温度30 ℃、pH值4.0、料液比1:8 g· mL-1及提取30 min的条件下, 分别采用100、200、300、400、500、600 W的超声波提取功率, 考察超声波功率对火龙果果皮红色素提取率的影响。
图8显示, 超声波功率达到300 W时, 果皮红色素的提取率最高, 之后随着超声波功率的增加, 果皮红色素的提取率呈下降趋势。因此, 300 W为最佳提取条件。
对超声波辅助提取法和传统溶剂浸提法进行比较分析, 并以机械搅拌作为对照处理。由表1可知, 在同样的料液比和温度情况下, 超声波提取由机械提取的120 min和溶剂浸取的30 min缩至15 min, 而果皮红色素的得率确得到增加。说明超声波辅助提取法比传统浸取法和机械搅拌法省时、省溶剂, 且提取得率更高。
| 表1 不同提取方式效果比较 |
对溶剂浸取方法的条件进行优化处理表明, 以40%的乙醇作为提取溶剂, 在料液比1:8 g· mL-1、提取温度30 ℃、提取pH值4.0及提取时间30 min的条件下, 火龙果果皮红色素的得率为最佳, 可达7.36%。在此基础上采用超声波辅助提取火龙果果皮红色素, 研究表明, 在其他条件相同的情况下, 提取时间缩短为15 min, 火龙果果皮红色素的提取率可达7.78%。与传统的溶剂浸取方法相比, 应用超声波辅助提取火龙果果皮红色素具有提取周期短、溶剂用量少、提取率高的优点。多次试验表明, 该方法有较好的重复性, 且操作稳定性高。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|