作者简介:刘晓霞(1986—),女,山东胶州人,博士,农艺师,从事土肥技术推广工作,E-mail:10914048@zju.edu.cn。
采用水培试验研究了供氮水平对不同基因型菠菜(全能、好运先锋)生物量、抗氧化物质含量和抗氧化能力的影响。结果表明,不同基因型菠菜地上部生物量随着供氮水平的提高呈先升高后降低的趋势,供给8或14 mmol·L-1硝态氮时,菠菜地上部生物量达到最高值;供给较高浓度的硝态氮(20 mmol·L-1)时,全能菠菜地上部生物量显著高于好运先锋;供氮水平由2 mmol·L-1提高到14 mmol·L-1时,供试的2个菠菜基因型还原型抗坏血酸和总酚含量达到最高值,继续提高供氮水平,还原型抗坏血酸和总酚含量显著下降。不同基因型菠菜总抗氧化活性(FRAP值)和自由基清除率(DPPH)均随着供氮水平的提高显著降低,基因型间FRAP值无显著差异,但供给2 mmol·L-1硝态氮时,全能菠菜DPPH显著高于好运先锋。由此可见,供氮浓度为8 mmol·L-1时,可基本满足不同菠菜基因型生长的需要,在保持较高生物量的同时,具有较高的抗氧化物质含量和抗氧化能力。
蔬菜是人们日常生活中不可或缺的重要食物, 富含维生素、氨基酸、纤维素和矿物质等多种有益物质, 对于改善人体营养水平、增进人体健康具有重要作用[1, 2]。此外, 蔬菜中富含的多酚、类黄酮等生物活性物质可有效预防癌症、心血管等慢性疾病[3, 4]; 因此, 提高蔬菜中生物活性物质含量是增进人体健康的有效途径[5]。
蔬菜抗氧化能力不仅与其遗传特性, 如种类、品种、生育期以及组织、器官等因素有关[6], 同时还受到养分供应等环境因素的影响[7, 8]。氮素营养是影响蔬菜抗氧化能力的重要因素。Stewart等[9]发现, 拟南芥总酚累积与氮素有效性密切相关; Sá nchez等[10]发现大豆作物体内抗氧化物质的含量随着供氮水平的提高而显著增加; 但Bé nard等[11]和Ková
供试菠菜基因型分别为全能和超阪急∙ 好运先锋(简称好运先锋)。
试验设置4个供氮水平:N2(2 mmol· L-1硝态氮)、N8(8 mmol· L-1硝态氮)、N14(14 mmol· L-1硝态氮)、N20(20 mmol· L-1硝态氮)。每处理重复3次。菠菜幼苗长至4叶1心时, 移植至20 L培养箱中, 每箱定植20株。以Hoagland营养液为基础营养液配方, 微量元素按Arnon配方。2 mmol· L-1氮水平的Hoagland营养液供应7 d后, 以不同氮水平的Hoagland营养液进行培养。试验过程保持连续通气, 昼夜温度分别为20/15 ℃。
还原型抗坏血酸(AsA)含量参照孙园园等[13]的方法测定。取0.5 g鲜样, 以5 mL预冷的偏磷酸溶液研磨, 后于4 ℃下10 000 g离心15 min。取上清液0.2 mL, 加入0.2 mL NaH2PO4和0.2 mL H2O。室温下放置30 s, 依次加入0.4 mL 10% TCA、0.4 mL 44%磷酸、0.4 mL二联吡啶、0.2 mL FeCl3, 37 ℃水浴1 h, 于525 nm波长下测定吸光度。
多酚含量采用Folin-Ciocalteu法测定[14]。取鲜样0.3 g, 加入3 mL 80%的甲醇, 冰浴研磨, 于4 ℃下12 000 g离心15 min。取0.3 mL上清液, 加入1.7 mL去离子水, 加0.5 mL已稀释2倍的福林酚试液, 加1.5 mL 26.7% Na2CO3溶液, 加6 mL去离子水后测定760 nm波长下的吸光度。以没食子酸作标准曲线。
自由基清除率参照Tadolini等[14]的方法测定。取0.5 g鲜样, 加入3 mL无水乙醇, 冰浴研磨, 于4 000 g离心10 min。取上清液0.5 mL, 加入2.5 mL DPPH, 摇匀, 于30 ℃水浴30 min, 于517 nm波长下测定吸光度Aj。取0.5 mL上清液与2.5 mL无水乙醇混合后于同样波长测定吸光度Ai。将0.5 mL无水乙醇与2.5 mL DPPH溶液混合后于同样波长测定吸光度A0。DPPH自由基清除率=[1-(Aj-Ai)/A0]× 100%。
总抗氧化活性(ferric reducing antioxidant power, FRAP)按Benzie等[15]的方法测定。取0.1 mL提取液(提取方法同DPPH自由基清除率), 加入2.9 mL(Fe3+-三吡啶三吖嗪)工作液[由100 mL醋酸缓冲液+10 mL TPTZ(2, 4, 6-反式2-吡啶基三嗪)+10 mL FeCl3· 6H2O组成]。混匀, 于37 ℃反应10 min, 在593 nm下测定吸光度。以1.0 mmol· L-1 FeSO4为标准, FRAP值以达到相同吸光度所需的FeSO4的毫摩尔数表示。
数据统计分析采用DPS 2000软件, 对有显著差异的处理采用Duncan’ s新复极差法进行多重比较, 利用Origin 9.0软件制图。
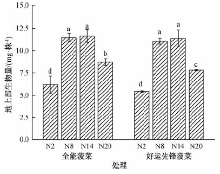
由图1可见, 不同基因型菠菜地上部生物量(鲜重)随着供氮水平的提高呈现先升高后降低的趋势, 供给8或14 mmol· L-1的硝态氮时, 菠菜的生物量最大, 且显著高于供给2和20 mmol· L-1的硝态氮。供给2、8和14 mmol· L-1的硝态氮时, 两个基因型菠菜地上部生物量无显著差异, 但供给较高氮浓度(20 mmol· L-1)时, 全能菠菜地上部生物量显著高于好运先锋。
抗坏血酸又称VC, 广泛存在于新鲜果蔬中, 能够缓和多种疾病的氧化应激, 保护机体免受内源性氧自由基的损伤。抗坏血酸包括还原型抗坏血酸和脱氢型抗坏血酸, 新鲜蔬菜中的抗坏血酸主要以还原型抗坏血酸形式存在[16, 17, 18, 19, 20]。由图2可见, 不同基因型菠菜叶片还原型抗坏血酸的含量随着供氮水平的提高呈现先升高后降低的趋势, 供氮水平为14 mmol· L-1时, 菠菜叶片还原型抗坏血酸含量达到最高值, 继续提高供氮水平, 还原型抗坏血酸含量显著降低。菠菜还原型抗坏血酸的含量存在显著的基因型差异, 好运先锋叶片还原型抗坏血酸含量显著高于全能。
酚类化合物是植物体内最丰富的次生代谢产物, 具有抗氧化、杀菌、清除自由基、消炎等功
能。由图3可知, 不同基因型菠菜叶片总酚含量随着供氮水平的提高呈现低-高-低的变化趋势, 总酚含量在供氮水平为14 mmol· L-1时达到最高值。两种基因型菠菜总酚含量在供给8 mmol· L-1硝态氮时差异显著, 其他供氮水平下基因型间总酚含量无显著差异。
蔬菜体内抗氧化物质繁多, 常用总抗氧化活性FRAP值和自由基清除率DPPH来评价其总抗氧化能力[15]。由图4可知, 不同基因型菠菜叶片FRAP值和DPPH自由基清除率均随着供氮水平的提高而降低, 供氮水平为20 mmol· L-1时, FRAP值和DPPH自由基清除率降至最低。基因型间FRAP值无显著差异, 但供给2 mmol· L-1硝态氮时, 全能菠菜自由基清除率DPPH显著高于好运先锋菜。
蔬菜富含多种与人体健康密切相关的抗氧化物质, 此类物质可缓和多种疾病的氧化应激, 保护机体免受内源性氧自由基的损伤[17, 18]。研究发现, 膳食中蔬菜摄入量与慢性病降低速率呈正相关[19], 这是由蔬菜中富含的VC、总酚等抗氧化物质以及一些抗氧化酶所产生的抗氧化效应引起的[20]。因此, 通过一定的农艺措施调控蔬菜抗氧化物质含量、提升抗氧化能力具有重要意义。本研究结果显示, 菠菜还原型抗坏血酸和总酚含量均随着供氮水平的提高呈现先升高后降低的趋势。虽然菠菜叶片FRAP值和DPPH自由基清除率均随着供氮水平的提高而逐渐下降, 但8 mmol· L-1的供氮水平下仍能维持较高的抗氧化活性。
氮素是作物生长发育过程中必需的大量元素之一, 作为作物的主要增产因子, 氮肥在农业生产中发挥了重要的作用, 其对作物产量的贡献率高达40%~50%[9]。本研究结果显示, 不同菠菜基因型生物量均随着供氮水平的提高先升高后降低。可见, 过高、过低浓度的氮素供应均不利于菠菜的生长发育, 综合考虑经济投入, 8 mmol· L-1为有利于菠菜生物量积累的适宜供氮水平。
综上所述, 不同基因型菠菜在供给8 mmol· L-1硝态氮时, 生物量、还原型抗坏血酸和总酚含量均达较高水平, 且能维持较高的抗氧化能力, 因此, 8 mmol· L-1硝态氮是菠菜水培条件下较为适宜的供氮浓度。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|