作者简介:常瑞刚(1995—),男,陕西岐山人,在读本科生,E-mail:1220654065@qq.com。
动物遗传育种的研究以及基因工程等分子水平的操作均需从生物体中提取基因组DNA。提取的DNA质量会影响后续实验结果的可靠性,提取方法是影响DNA质量的一个重要因素。本实验采用酚-氯仿抽提法与DNA提取试剂盒法在相同温度条件下(4 ℃)提取猪耳组织DNA,以探讨不同提取方法对DNA质量的影响。结果表明:用酚-氯仿抽提法所提取的DNA经凝胶数字成像系统分析显示其条带更宽更亮,说明含量较高,浓度更大,但点样孔有少许污染,蛋白质未除干净;而用新兴的试剂盒所提取的DNA虽然浓度不是很高,但无污染,可直接用于PCR以及酶切等后续实验。
随着分子生物学技术的不断发展, 动物遗传育种的研究以及基因工程等分子水平的操作均需从生物体中提取基因组DNA。提取的DNA质量会影响后续实验结果的可靠性, 而提取过程中DNA的质量受多种因素的影响, 其中不同提取方法是影响其质量的一个重要因素。本实验采用酚-氯仿抽提法与DNA提取试剂盒法在相同温度条件下(4 ℃)提取猪耳组织DNA, 探讨不同提取方法对DNA质量的影响。
以青海互助种猪场的八眉猪为试验动物。取仔猪耳组织5~6块, 置于盛有75%乙醇的EP管中, 放入冰盒中带回实验室, 在-20 ℃冻存备用。
基因组DNA提取试剂盒、蛋白酶K、Tris平衡酚、氯仿-异戊醇、NaAc、冰无水乙醇、75%乙醇、1× TE缓冲液。
自动平衡离心机Labofuge 200和高速冷冻离心机D-37520(德国Eppendorf公司), 低温冰箱MDF-U541(日本SANYO电子有限公司), 微量移液器(德国Eppendorf公司), 普通PCR仪T1(德国Biometra公司), 凝胶数字成像系统BiO-BEST 140E(美国西蒙公司)等。
试剂盒法。依据TIANamp Genomic DNA Kit(离心柱型)说明书进行操作。
酚-氯仿抽提法。根据《分子克隆实验指南》中DNA提取方法进行操作[1]。取约30 mg的猪耳组织样品, 放入1.5 mL离心管中, 用手术剪刀剪碎(尽量剪的细小, 便于消化)。加入600 μ L DNA提取液, 上下翻转混匀。加入10 μ L蛋白酶K, 封口后置于55 ℃水浴中震荡12 h 或更长, 直至组织完全消化。待耳组织全部被消化后将样品从水浴锅中取出, 冷却至室温后加入600 μ L Tris平衡酚, 缓慢颠倒摇晃10 min, 4 ℃ 12 000 r· min-1离心10 min。吸取上清液, 加入600 μ L Tris平衡酚, 缓慢颠倒摇晃10 min, 4 ℃ 1 2 000 r· min-1离心10 min。吸取上清液, 加入300 μ L Tris平衡酚和300 μ L氯仿-异戊醇, 缓慢颠倒摇晃10 min, 4 ℃ 12 000 r· min-1离心10 min。吸取上清液, 加600 μ L氯仿-异戊醇, 缓慢颠倒摇晃10 min, 4 ℃ 12 000 r· min-1离心10 min。 吸取上清液, 加入60 μ L NaAc和在-20 ℃充分预冷的冰无水乙醇1 000 μ L, 轻微摇晃后即可出现乳白色丝状DNA絮状沉淀, 然后将样品置于冰中15 min后取出, 4 ℃ 12 000 r· min-1 离心10 min。 弃去上清液, 加75%乙醇1 000 μ L, 12 000 r· min-1离心2 min, 重复操作1次。然后将离心管置于室温下自然干燥。待乙醇完全挥发后, 加入30 μ L 1× TE缓冲液(参考文献[1]为加200 μ L 1× TE), 4 ℃放置24 h以溶解DNA, 后置于-20 ℃保存备用。
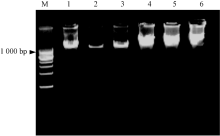
本实验结果采用0.8%琼脂糖凝胶电泳分析显示(图1), 2种方法所提取的DNA含量均较高。但相比之下酚-氯仿抽提法所提取的DNA含量更高, 浓度更大, 与DNA Marker片段相比, 除样品条带外未出现其它条带, 表明所提取的DNA未受外源核酸和蛋白质的污染, 且分子大小相同, 均在1 000 bp以上。6个试验样品迁移率几乎相同。
本实验结果表明, 在相同温度条件下, 用传统的酚-氯仿抽提法所提取的DNA含量更高, 浓度更大, 条带更亮, 但点样孔有少许污染, 蛋白质未除干净; 而用新兴的试剂盒所提取的DNA虽然浓度不是很高, 但无污染, 可直接用于PCR以及酶切等后续实验。
The authors have declared that no competing interests exist.
| [1] |
|