作者简介:王迎儿(1985—),女,浙江宁波人,农艺师,硕士,从事瓜类砧木育种工作,E-mail:wangyinger0601@sina.com。
以主要来源于浙江省的41份南瓜种质资源为材料,利用26对南瓜SSR标记对其进行遗传多样性及亲缘关系分析。结果表明,41份种质被分为4类,2类为白籽南瓜(各1份),1类中国南瓜(35份),1类印度南瓜(4份)。材料间的遗传相似系数介于0.45~0.96,平均为0.79。其中,中国南瓜类群种内平均相似系数为0.86,印度南瓜类群种内平均相似系数为0.67,这2个类群间的平均相似系数为0.54。所收集的浙江省种质资源除其中2份外,均被分类为中国南瓜,平均遗传相似系数为0.87。中国南瓜的亲缘关系较印度南瓜近,种内亲缘关系较种间近。研究结果对浙江省南瓜种质资源保护和开发利用具有重要意义。
南瓜(Cucurbita L.)为1年生草本植物, 属于葫芦科南瓜属, 在世界范围内广泛栽培。栽培种主要分为5类, 包括美洲南瓜(Cucurbita pepo)、中国南瓜(C. moschata)、印度南瓜(C. maxima)、黑籽南瓜(C. ficifolia)和灰籽南瓜(C. mixta), 用途广泛, 营养丰富, 变种繁多[1, 2]。南瓜起源于美洲大陆, 明代由东南亚、朝鲜和日本等地传入我国, 距今近500多年的历史[3]。传入中国后, 由浙江、福建等东南沿海地区向内地扩展, 在多年栽培扩展过程中产生了丰富的表型及遗传变异。对育种工作者而言, 种质资源是品种培育的基础, 而种质资源的收集及评价分析则是种质资源利用的必需过程, 可为杂交育种中亲本选配提供依据, 有利于优良品种的选育。地方种质资源在地区气候环境适应性方面具有一定优势, 具有丰富的生物及非生物胁迫抗性遗传资源, 适宜用作地方品种的选育基础[4]。因此, 开发利用地方种质资源已成为育种的重要发展方向, 对品种选育具有重要意义。
遗传多样性是种质资源评价的重要指标, 主要包括表型水平和分子水平2个方面。通过SSR等分子标记在分子水平对种质资源进行多样性评价, 相对表型水平受环境影响较小, 重复性及稳定性较高, 因此, 在分子水平对种质资源遗传多样性进行评价, 可靠性更高[5, 6]。目前, 国内外学者为了从分子水平研究南瓜种质资源的遗传多样性, 已经利用过氧化物同工酶[7]、RAPD[8, 9, 10, 11, 12, 13, 14]、AFLP[15]、SSR[16, 17, 18]、EST-SSR[19]、SRAP[20]、ISSR[13, 14, 21]等分子标记对国内外种质资源进行栽培种内及栽培种间的遗传多样性进行分析。但是作为南瓜在国内传播的重要节点, 浙江相关的地方种质资源少有涉及。本研究以浙江省为主的41份南瓜种质资源为研究材料, 利用SSR分子标记对其进行遗传多样性分析, 旨在为南瓜种质资源保护及新品种选育提供参考。
材料于2016年秋季种植于宁波市农业科学研究院宁波市高新农业技术实验园区设施大棚内, 每份材料定植15株。开花期对每份材料随机选取4株取幼嫩叶片, 混合后进行基因组DNA提取。DNA提取方法参照文献[22]。利用超微量分光光度计检测DNA质量及浓度, 稀释至20 ng· μ L-1后进行PCR扩增。
SSR引物序列参考文献[23], 本研究选取其中扩增条带清晰、稳定、多态性高的50对引物进行分析, 引物由上海英潍捷基生物公司合成, 引物序列见表2。PCR扩增体系10 μ L:DNA(20 ng· μ L-1)2 μ L, 10× PCR buffer 1 μ L, 25 mmol· L-1 MgCl2 0.8 μ L, 10 mmol· L-1 dNTP 0.16 μ L, 10 mmol· L-1 Primer 1 μ L, Taq酶(全式金)0.1 μ L, dd H2O 4.94 μ L。PCR程序:94 ℃ 4 min; 94 ℃ 45 s, 65 ℃ 30 s(每循环降0.7 ℃), 72 ℃ 1 min, 10个循环; 94 ℃ 45 s, 56 ℃ 30 s, 72 ℃ 1 min, 25个循环; 72 ℃ 10 min, 25 ℃ 10 min。扩增产物用0.6%变性聚丙烯酰胺凝胶进行电泳检测, 常规硝酸银染色法银染。
为了后续SSR分析, 对每个多态性位点, 出现及缺失的PCR扩增带纹分别赋值为1和0。通过NTSYSpc 2.10e软件进行数据分析, 获得材料间的遗传相似性及遗传距离, 并进一步绘制树状聚类图。
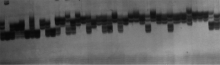
利用50对SSR引物对收集的41份南瓜种质材料进行分析, 结果(表2)显示, 26对引物具有多态性, 多态性条带141条, 平均5.42条。扩增多态性条带最多的为标记S198, 共有17条, 最少的为S125, 只有1条。多态性信息含量平均0.58, S198的多态性信息含量最高, 为0.91, S312的多态性信息含量最低, 为0.32。图1为SSR引物S264对41份南瓜种质材料的扩增电泳图谱。
基于SSR数据, 通过NTSYSpc 2.10e统计41份南瓜资源的遗传相似系数。材料间的遗传相似系数为0.45~0.96, 平均为0.79。其中51与52、79与84之间的遗传相似系数最大, 为0.96, 表明这2对种质资源之间的亲缘关系最近。73与85之间的遗传相似系数最小, 为0.45, 表明这2份种质资源间的亲缘关系最远。
利用26对SSR引物得出的电泳谱带数据进行聚类分析, 得到聚类树状图(图2)。
| 表2 26对SSR引物序列及扩增结果 |
由图2可知, 在阈值为0.13时, 41份南瓜种质资源划分为4个类群。第Ⅰ 类群包括1份材料, 编号47, 为白籽南瓜; 第Ⅱ 类群包括4份材料(编号72、73、89、90), 为印度南瓜; 第Ⅲ 类群包括35份材料, 为中国南瓜; 第Ⅳ 类群包括1份材料87, 为白籽南瓜。
第Ⅰ 类群与第Ⅱ 类群的平均相似系数为0.61, 编号47与90的相似系数达0.69, 编号47与89的相似系数为0.55。第Ⅰ 类群与第Ⅲ 类群的平均相似系数为0.70, 编号47与48的相似系数达0.77, 编号47与83、91的相似系数为0.64。第Ⅰ 类群与第Ⅳ 类群的平均遗传相似性为0.55。第Ⅱ 类群与第Ⅲ 类群的平均相似系数为0.54, 编号51与90的相似系数达0.65, 编号73与85的相似系数为0.45。第Ⅱ 类群与第Ⅳ 类群的平均相似系数为0.51, 编号87与72的相似系数达0.53, 编号87与90的相似系数为0.49。第Ⅲ 类群与第Ⅳ 类群的平均相似系数为0.62, 编号87与59的相似系数达0.68, 编号87与53的相似系数为0.58。第Ⅱ 类群中, 编号72与73的遗传相似性最大为0.82, 90与72、73的遗传相似性最小为0.62, 平均为0.67。第Ⅲ 类群的平均遗传相似性为0.86, 编号79与84、51与52的遗传相似性最大为0.96, 编号63与91的遗传相似性最小为0.73。47和87这2份白籽南瓜与印度南瓜的平均遗传相似性为0.56, 与中国南瓜的平均遗传相似性为0.66。2份白籽南瓜与印度南瓜类群的遗传相似性较中国南瓜类群低, 表明所收集的2份杂交材料的中国南瓜背景较大。中国南瓜类群内遗传相似性显著高于印度南瓜类群。除了编号87与印度南瓜类群外, 印度南瓜和中国南瓜类群间的遗传相似性最低, 亲缘关系最远。中国南瓜类群内的遗传相似性最高, 内部亲缘关系最远的为0.73, 最高达到0.96; 其中, 浙江省的中国南瓜材料平均相似系数为0.87, 编号79与84、51与52的相似系数最大, 均为0.96; 63与91的相似系数最小, 为0.73。
南瓜自明代传入我国浙江和福建以来, 迅速北上南下, 成为解决人民温饱的重要农作物[24]。因此, 收集并研究浙江地区南瓜种质资源情况对了解我国南瓜的推广及种质资源利用和培育具有重要作用。本研究中, 浙江地区收集的种质资源主要为中国南瓜, 平均遗传相似系数为0.87, 多个地区总体亲缘关系较近, 遗传多样性不够丰富。这或许与南瓜引入我国时间较短, 自然及人为选择压力不大有关。因此, 为选育优良品种, 仍需创造或引进变异更丰富的种质资源。
SSR分子标记因其重复性高、基因组分布及数量丰富等优势而在种质资源评价、遗传进化、分子育种等方面而被广泛应用[25]。但是在南瓜种质资源评价中的应用还较少[16, 17, 18]。最近, 超过500对南瓜SSR分子标记被公布[23]。本研究从中随机选择50对SSR分子标记对41份南瓜种质资源进行遗传多样性分析, 结果有26对分子标记具有多样性。这26对标记平均扩增多态性条带5.42条, 高于已知的4.18、2.4以及2.29[16, 17, 18], 这可能与所选择的分子标记位点受自然及人工选择压力较小有关。
本研究所用材料有印度南瓜、中国南瓜及白籽南瓜3类, 其中2份白籽南瓜因为亲缘关系较远而被分在2个类群。总体上, 种间亲缘关系较种内远, 中国南瓜种内亲缘关系较印度南瓜近。这与已发表的利用SSR、ISSR、SRAP等分子标记分析结果一致[16, 26, 27]。但与利用同工酶对南瓜亲缘关系研究结果不一致, 这可能与材料及标记的选择有关[7]。
目前蔬菜种子市场混乱, 具有同名异物和同物异名现象。另外, 由于农家留种大多无名称或名称不清楚, 极易造成种质资源重复收集及收集遗漏。本研究中51与52、79与84间的遗传相似性高达0.96, 疑为同一材料短时间内分离而来, 已发表研究也有类似结果[27]。75与76这两份来自浙江舟山的材料虽然具有同一名字, 但材料间遗传相似性为0.88, 表明材料间具有一定程度的差异, 对密本南瓜的研究中也发现类似现象[26]。本研究中编号47的材料, 因为可自交结实收种, 通过外观初步归为印度南瓜; 但该材料为印度南瓜与中国南瓜的杂交材料, 虽然可自交收种, 但种子量较少, 结合田间植株详细表现, 最终认为该材料为种间杂交材料。
本研究利用SSR标记对收集的南瓜种质资源进行遗传多样性分析, 进一步分析了中国南瓜、印度南瓜及白籽南瓜3个栽培种的遗传多样性, 构建了聚类图谱。虽然本研究中印度南瓜及白籽南瓜材料较少, 但仍可以为南瓜亲本选配和品种选育提供参考。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|