作者简介:彭安琪(1993—),女,江西吉安人,硕士,从事园林植物栽培与管理研究工作,E-mail:517557523@qq.com。
采用干旱停水法,探究当年生朝鲜婆婆纳对干旱胁迫的生理响应。停止浇水后土壤含水量降低,朝鲜婆婆纳株高增长量逐渐减小,叶片相对含水量先增加后显著下降,叶片相对电导率显著上升,叶绿素a与叶绿素b的比值在一定范围内波动,脯氨酸含量逐渐上升,可溶性糖、可溶性蛋白、POD活性、SOD活性先升后降,表明朝鲜婆婆纳的耐旱能力弱,如需推广应加强水分管理。
野生花卉抗逆性强、栽培简单、管理粗放, 近年来园林绿化中愈来愈重视其利用价值, 若能把它们在实际中应用推广, 不仅可增加新颖性和观赏性, 还能体现地域性, 避免生物入侵。朝鲜婆婆纳(Veronica rotunda)是尚未被开发应用的一种极具观赏价值的草本之一, 在园林中开发应用的潜力非常广阔。朝鲜婆婆纳, 玄参科婆婆纳属, 辽宁、山西、河南(商城)、安徽(岳西)、朝鲜、浙江(临安)均有分布。多年生草本, 茎单生, 高约1 m, 卵形叶片宽大。对水肥条件要求不高, 多生于山坡草地, 花序柔美靓丽, 花冠蓝色或蓝紫色, 少白色, 花期在6— 8月[1]。
目前, 朝鲜婆婆纳在园林应用中的相关报道较少, 相关研究主要集中于化学物质的提取开发和朝鲜婆婆纳的组织培养, 其水分适应性尚未见报道。水分胁迫是植物面临的主要逆境之一, 研究植物对水分胁迫的响应和适应, 是认识植物与环境的一条重要途径, 也可为植物在园林绿化中的合理配置提供依据。为了满足现代绿化环境建设发展的需要, 使抗性强的野生品种能够得到合理配置和扩大应用范围, 本文研究了朝鲜婆婆纳对水分的适应性。
朝鲜婆婆纳于2016年5月采自杭州临安市清凉峰, 在直径12 cm的营养钵内装入湿度基本一致的栽培基质, 去除土中的石块等杂质, 选择长势基本一致的当年生植株进行移栽, 尽量使每盆质量一致, 置于浙江农林大学园林学院温室大棚培养。
处理用植株共15盆, 每盆2株。2016年7月10日完全浇透水后作停水处理, 处理第0、4、8、12、16、20、24天测定相关生理指标, 指标包括土壤含水量、植株外部形态、叶片相对含水量、叶片相对电导率、叶绿素含量、可溶性糖含量、SOD活性、POD活性、游离脯氨酸和可溶性蛋白含量等。0 d为对照组(CK), 试验重复3次。试验材料均于早晨8:30取样, 叶片剪下后迅速置于冰袋中, 样品当天处理分析完毕。
土壤含水量采用烘干法[2]进行测定; 株高增长量表示相同测定时间间隔内(4 d)植株的高度差。叶片相对含水量的测定采取饱和称重法[3]; 植物相对电导率测定采用电导法[2]; 叶绿素含量用浸提法[2]测定; SOD酶活性采用氮蓝四唑(NBT)法[4]测定; POD酶活性采用愈创木酚法[4]测定; 脯氨酸(Pro)含量采用茚三酮溶液显色法[5]测定; 可溶性糖含量采用蒽酮比色法[5]测定; 可溶性蛋白质含量采用考马斯亮蓝法[6]测定。
所有数据用Excel 2003整理, 用SPSS 22.0进行统计分析。
从图1可以看出, 土壤含水量随着停水时间的延长而不断减少, 胁迫第0、4、8、12、16、20、24天, 土壤含水量分别为82.4%、63.3%、51.3%、34.0%、16.8%、11.0%、6.6%。第0~4天, 土壤含水量属于正常水平; 第8天, 土壤含水量为田间持水量的60%, 到达轻度胁迫水平; 第12天土壤含水量为田间持水量的40%, 达到中度胁迫水平; 第16~20天土壤含水量低于田间持水量的20%, 已经达到重度胁迫水平; 第24天已达到严重干旱水平[7]。
干旱胁迫24 d后, 朝鲜婆婆纳植株高度平均增加13.9 cm。从图2可以看出, 随着胁迫时间的延长, 株高增长量极显著降低。朝鲜婆婆纳在前12 d正常生长, 未发生明显变化; 16 d时, 大部分叶片开始出现卷边, 相同时间内株高增长量下降至1.6 cm。干旱胁迫后期叶片发生明显焦边、耸拉, 株高增长量仅为0.7、0.5 cm; 16 d时有2株植株出现死亡, 20 d时9株植株彻底萎蔫, 到24 d时只有15株存活。
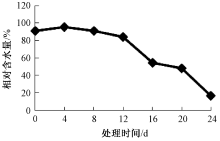
叶片相对含水量是判定植物保水力的重要指标之一, 可以直接反映植物的水分状况[8]。如图3所示, 第0、4、8、12、16、20、24天朝鲜婆婆纳叶片含水量分别为91.0%、95.4%、90.8%、84.3%、54.4%、48.0%、16.5%。由于第0天浇透水, 第4天叶片相对含水量反而上升4.4百分点, 随着干旱胁迫时间的延长, 叶片相对含水量极显著降低, 与对照组(0 d)相比, 分别下降了0.2、6.7、36.6、43.0、84.5百分点。
叶片电导率可反映植物受伤害的程度, 可用来分析植物的抗逆性强弱[9]。图4表明, 朝鲜婆婆纳叶片相对电导率随着干旱程度的加剧显著升高。0~16 d, 叶片相对电导率的变化幅度较小, 16~20 d明显上升, 达到45.4%, 干旱胁迫第24天, 相对电导率上升至82.8%。
叶绿素与植物光合作用密切相关, 是反映光合作用变化规律和植物抗旱性的直接指标[10]。由图5可知, 干旱胁迫下叶绿素a、b、叶绿素总含量以及类胡萝卜素含量的变化趋势相同, 均在4~8 d显著下降, 之后总体呈现上升趋势。叶绿素a/叶绿素b在一定范围(1.67~2.37)内波动。
逆境条件下, 脯氨酸的积累与植物抗性有显著关系, 抗性越强的植物脯氨酸变化幅度越大。由图6可以看出, 干旱胁迫下脯氨酸含量呈波动上升的趋势, 20 d后大部分叶片发生萎蔫时, 脯氨酸含量急剧上升。从开始时0.19 μ g· g-1最终增加到0.78 μ g· g-1, 约为对照组脯氨酸含量的4.1倍。
由图7可以看出, 随着干旱胁迫时间的延长, 可溶性糖含量变化可分为2个阶段:干旱胁迫0~8 d, 可溶性糖含量随着胁迫时间的延长而增加, 4 d和8 d时, 较对照组分别增长了113.2%和282.0%, 可溶性糖大量累积, 第8天最高(348.42 mg· g-1); 干旱胁迫8~24 d, 可溶性糖合成受到抑制且被分解, 含量开始下降, 24 d时降至254.88 mg· g-1。
可溶性蛋白在各种酶类代谢中起调控和促进作用, 植物可以通过渗透调节减轻逆境胁迫对植物体的伤害。由图8可以看出, 可溶性蛋白含量的变化呈先上升后下降的趋势。在0~16 d, 可溶性蛋白含量随着干旱胁迫时间的延长而不断累积, 涨幅分别为172.5%、177.3%、230.7%、288.0%, 含量最高时达到11.43 mg· g-1。当植物叶片开始萎蔫后, 蛋白质累积程度小于分解程度, 含量开始下降, 干旱胁迫20和24 d, 可溶性蛋白含量降幅分别为41.1%和74.0%, 到第24天可溶性蛋白含量仅为2.97 mg· g-1。
从图9可以看出, 干旱胁迫0~12 d, SOD活性呈现缓慢上升趋势, 细胞膜脂过氧化加强, SOD活性在第12天最高, 为340.47 U· g-1。12~24 d, SOD活性呈现逐渐下降趋势, 第24天大部分植株萎蔫, SOD活性达到最低值, 为235.5 U· g-1。主要是因为胁迫后期含水量和气孔导度的降低导致歧化反应产生的
POD为活性氧清除酶系统的重要保护酶之一, 干旱胁迫对朝鲜婆婆纳叶片POD活性的影响见图10。POD活性呈现先上升后下降的变化趋势, 且每个阶段变化幅度不同。干旱初期(0~4 d), POD活性变化幅度不大; 4~12 d, POD活性显著上升, 第8、12天达到908.15和2 252.19 U· g-1· min-1, 第12 d达到最大值; 干旱胁迫12 d之后POD活性开始下降, 16、20、24 d降幅为18.2%、76.0%、85.2%, 第24d时降到333.33 U· g-1· min-1, 这表明植株已受到严重胁迫。
植物面对干旱胁迫有其特有的保护机制, 从不同生理指标的响应可以对植物抗旱性进行评估。试验表明朝鲜婆婆纳抗旱能力弱, 对干旱胁迫较敏感, 生长受到明显抑制, 叶片失水严重, 各项生理指标均受到显著影响, 干旱后期甚至死亡。短期干旱胁迫可以适应, 如需在园林美化和实际城市绿化中应用, 应该加强其水分管理。
水分胁迫下植物表现为植株生长减弱, 生物量分配发生变化, 干旱初期植物生物量向根部的分配增加, 但在严重水分胁迫下, 由于碳向地下组织的分配受到限制, 因而根和枝条的生长都受到抑制, 生物量和高度都显著降低。干旱胁迫下, 朝鲜婆婆纳生长速率明显受到抑制, 株高增长量逐渐减小, 植株死亡率上升, 表明朝鲜婆婆纳对水分敏感, 干旱对其影响较大。
水在植物中发挥着重要的作用, 一般占植物组织的65%~90% [12]。叶片相对含水量可以反映叶片水分生理状态, 是植物在受到胁迫后组织水分缺损状态的直接反应, 是检验植物抗旱性的重要指标。植物抗旱性越强, 其保水能力越强, 叶片相对含水量变化幅度越缓。本实验中, 朝鲜婆婆纳的相对含水量随着土壤含水量的下降呈现明显下降趋势, 与刘琛彬等[13]对婆婆纳抗旱性的研究一致, 虽然朝鲜婆婆纳保水能力比婆婆纳强, 但是其抗旱能力仍较弱。
植物组织受到逆境伤害时, 膜功能受损或结构破坏而透性增大, 叶片相对电导率是直接反映植物膜系统状况的指标[14]。细胞内水溶性物质外渗, 细胞膜渗透性增加, 电导率增强, 且膜伤害越重, 电解质外渗增多, 电导率越大[15]。从本试验可以看出, 朝鲜婆婆纳受到干旱胁迫后, 细胞膜受损严重, 叶片相对电导率显著上升, 表明朝鲜婆婆纳对干旱环境极其敏感。
除此之外, SOD、POD等保护酶在消除超氧自由基、过氧化物以及阻止或减少羟基自由基形成等方面起重要的作用。抗氧化酶活性越高, 植物的抗逆性越强[16]。朝鲜婆婆纳受到干旱胁迫时, POD和SOD活性皆出现先上升后下降的趋势, 表明干旱胁迫下, 朝鲜婆婆纳活性氧自由基的产生和清除代谢的平衡受到破坏, 使活性氧自由基的产生占据主导地位从而导致自由基含量过多积累且超过阈值, 进而引发或加剧了细胞的膜脂过氧化, 给植物体造成伤害[17]。
叶绿素含量在一定程度上能反映植物的光合能力。受到干旱胁迫时, 朝鲜婆婆纳Chl a/Chl b基本不变, 与刘琛彬等[13]和牟筱玲等[18]的研究结果一致。但由于叶绿素的合成受多种环境因素影响, 实验期间高温胁迫对实验也有一定的影响, 叶绿素含量变化也受到了一定的影响。干旱胁迫第8 d左右, 大棚内气温高达43 ℃, 导致叶绿素含量明显降低。
脯氨酸、可溶性糖、可溶性蛋白作为植物渗透调节物质, 三者的变化情况可以一定程度上反映植物抗旱能力的强弱。本研究中, 脯氨酸含量随着干旱胁迫时间的延长显著上升, 说明朝鲜婆婆纳体内的脯氨酸对逆境作出了积极的响应。可溶性糖和可溶性蛋白含量呈现先升后降的变化趋势, 这说明适当的干旱胁迫对朝鲜婆婆纳可溶性蛋白、可溶性糖的积累有利, 但是超过其可承受范围, 细胞结构受到破坏, 功能丧失, 可溶性蛋白、可溶性糖含量急剧下降, 抗逆境能力也减弱。
综上所述, 植株生长形态变化、植株存活率、叶片相对含水量、电导率、抗氧化酶活性、可溶性糖及可溶性蛋白等指标均表明朝鲜婆婆纳抗旱性较弱。植物抗旱性受到多方面因素影响, 本试验只探讨了一部分指标, 需进一步对其他生理指标和光合指标进行测量, 以便于客观公正地评价其水分适应性。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|