作者简介:陈丽萍(1979—),女,助理研究员,研究方向为农药应用及环境安全性评价,E-mail: chenlp1979@163.com。
试验3种常见重金属对大型溞的急性毒性。结果表明,Hg2+、Ni+、Mn2+ 3种重金属对大型溞的48 h的EC50值分别为0.0211、2.18和35.6 mg·L-1,其毒性大小依次为Hg2+>Ni+>Mn2+。根据化学农药环境安全评价试验准则第13部分溞类急性活动抑制试验中的分级标准,本研究测定的Hg2+对大型溞毒性为剧毒级,Ni+为中毒级,Mn2+为低毒级。
近年来, 环境污染问题越来越被人们关注。随着人口的急剧增长, 工农业与经济的飞速发展, 生活污水、农业用水、工业废水等各种废污水使水环境遭受严重的污染, 使得水生生物的生存面临前所未有的威胁。重金属作为一类主要的环境污染物对水生生物的毒害作用, 是一个不可忽视的难题。各类水体重金属污染日趋加剧已经成为不争的事实[1, 2]。由于水生生态系统是整个生态系统的重要组成部分, 也是人类赖以生存的重要环境条件之一, 水生生态环境的恶化必然对整个生态系统造成破坏, 以致对人体健康造成严重危害[3], 所以重金属污染问题不容忽视。
大型溞(Daphnia magna Straus)属于浮游甲壳类动物, 是一种常见的水生生物, 以藻类为食, 同时还作为鱼和无脊椎捕食动物的饵料, 是水生生态系统中物质循环和能量流动的重要环节[4]。由于其具有生活周期短、繁殖快、对毒物敏感及易于在实验室培养等优点, 常被用作国内外水生生物毒理学研究的标准测试生物[5, 6, 7], 目前已被广泛应用于水体环境污染监测和水生生物毒性试验和评价中[8, 9, 10, 11, 12, 13, 14, 15]。由于重金属在位于食物链底端的大型溞体内具有较强的富集性, 可能会造成食物链的逐级富集, 从而威胁高级生物的健康[13]。而大型溞对于水体中的有害物质如重金属等比较敏感, 在低浓度时就会显著影响它们的生长繁殖、行为反应、形态和生理生化过程等[8, 9]。因此, 半致死浓度(EC50)法常用于水质监测, 为治理重金属污染水质环境提供依据。
目前有许多关于重金属对大型溞急性毒性的研究, 笔者曾做过Cu2+、Zn2+和Cd2+3种重金属离子对大型溞的毒性效应研究, 发现这3种重金属对大型溞均具有较强的毒性效应[16], Hg、Ni和Mn也广泛存在于自然界中, 是常见的水体重金属污染物[17]。本研究采用常见的Hg、Ni和Mn等3种重金属对大型溞的急性毒性进行研究, 并将3种重金属对大型溞的急性毒性进行综合比较和分析, 明确重金属对大型溞的剂量-效应关系, 从而为其对水生生物危害的风险控制提供基础数据和理论依据。
本研究以大型溞为试验对象, 按照我国“ 化学农药环境安全评价试验准则” [5]和OECD“ 化学品测试方法” [6, 7]的要求, 研究了3种重金属对大型溞的急性毒性, 并进行毒性级别评价, 旨在评价重金属在环境中暴露后对大型溞的安全性, 从而为其对水生生物的危害的风险控制提供科学依据。
受试生物为大型溞, 引自中国疾病预防控制中心环境与健康相关产品安全研究所, 为62D.M生物株。在良好的实验室培养条件下, 使其处于孤雌生殖状态, 并在实验室条件下培养3代以上, 选用出生6 h~24 h的幼溞进行试验。
受试重金属材料。HgCl2(贵州省铜仁汞矿化学试剂厂); NiCl· 6H2O(上海精细化工科技有限公司); MnSO4· H2O(上海试剂二厂)。
试验按照GB/T 31270.13— 2014“ 化学农药环境安全评价试验准则第13部分:溞类急性活动抑制试验” [5]的方法要求进行。试验前用蒸馏水将各试验药物配成一定浓度的母液备用。经预备试验, 确定各试验药物质量浓度范围后, 按等比设置6个质量浓度梯度组[18]。设处理组和对照组, 将50 mL试验药液加入到干净容器中, 然后放入试验溞, 试验用溞至少20只, 分成4组, 每组5只。每组试验液50 mL, 随机排列。试验药液与空白对照均用ISO标准稀释水配制, 试验期间水质保持稳定, 满足pH为6.0~9.0, 硬度(以CaCO3计)为140~250 mg· L-1, 溶解氧> 3.0 mg· L-1。不喂食, 不曝气, 培养箱内日光灯光照, 温度控制主要通过培养箱调节, 光照/黑暗时间比为16 h/8 h。试验开始和结束时, 应测定对照组和试验液的pH和溶解氧的浓度。试验液中的pH值不能调节。处理后24 h和48 h, 观察大型溞的受抑制情况并记录受抑制数。大型溞中毒症状表现为运动异常, 继而失去自由游动的能力, 沉在器皿的底部, 最后心跳停止、死亡, 大型溞急性活动抑制试验的受抑制标准为晃动烧杯15 s后不运动(但允许附肢微弱活动)。
对试验溶液的水温、pH值、硬度、溶解氧含量进行定期监测表明, 水体中溶解氧含量均在5.8 mg· L-1以上, 水温、pH值和硬度均满足试验方法的要求。试验期间实验室条件均符合准则要求, 且空白对照组死亡率< 10%, 表明本实验室的条件、设备、方法及试验水生生物的质量均符合试验要求。
从表1可以看出, 不同重金属对大型溞的急性毒性存在显著差异。供试的3种重金属离子中, Hg2+对大型溞毒性作用最高, 对大型溞毒性表现为剧毒性; 其次为Ni+, 表现为中毒性; Mn2+对大型溞毒性作用最低, 表现为低毒性。Hg2+、Ni+和Mn2+重金属离子处理大型溞后, 受试大型溞表现为沉底, 游动少, 不灵活。48 h半抑制浓度EC50和95%置信区间分别为0.0211(0.0203~0.0219)、2.18(1.81~2.62)和35.6(34.2~37.0)mg· L-1。
| 表1 重金属对大型溞的急性毒性作用 |
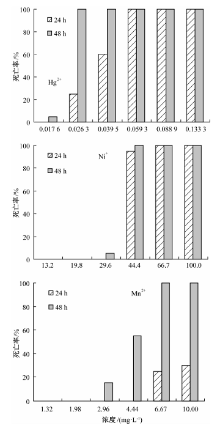
从图1可以看出, 随着重金属浓度的增加, 大型溞的死亡率整体表现为增加趋势, 且随着曝光时间的延长, 大型溞的死亡率也随之增加。曝光24 h时, 对大型溞的急性毒性顺序为Hg2+> Ni+> Mn2+; 随着曝光时间的延长, 重金属对大型溞的急性毒性表现出增加的趋势, 暴露48 h时, 除Hg2+处理组在低浓度0.0 176 mg· L-1引起大型溞的死亡率为5%之外, 其他重金属离子在低浓度时均未表现出对大型溞的急性毒性作用。但随着浓度增加, 各种重金属离子均表现出对大型溞的毒性作用。48 h时各种重金属对大型溞的急性毒性顺序为Hg2+> Ni+> Mn2+, 与曝光24 h时对大型溞的毒性次序一致。
本研究测定结果表明, 不同重金属对大型溞的急性毒性存在显著差异, 其中Hg2+对大型溞的急性毒性明显高于Ni+和Mn2+, 且Hg2+对大型溞的急性毒性是Mn2+对大型溞的急性毒性的1 687倍(48 h结果)。
露凌霞等[20]研究表明, Hg2+对大型溞具有较强的毒性, 毒性随浓度增加而增强, Hg2+的48 h的EC50值为0.023 mg· L-1, 此结果与本研究中Hg2+的48 h的EC50值为0.021 mg· L-1结果相近, Hg2+对大型溞毒性属于剧毒级毒。霍元子等[21]报道, Ni2+对西藏拟溞的48 h的EC50值为66.09 mg· L-1, 与本试验Ni2+对大型溞48 h的EC50为2.18 mg· L-1差距较大, 从毒性数据判断, 大型溞对Ni2+比西藏拟溞更敏感。通过其他重金属离子对西藏拟溞的急性毒性数据(如Cu2+、Zn2+的EC50)与董晓晓等[22, 23, 24]对大型溞毒性研究比较可以发现, 大型溞对大多数重金属离子的敏感性均高于西藏拟溞。
Mn2+对大型溞毒性虽然较低, 为低毒级, 但在工业废水、矿区水体等领域中存在, 对水生生物的影响仍然严峻[25]。
在水生生态环境中, 溞是水生生物食物链中重要的一员, 重金属污染水体后, 势必对水生生物造成危害。重金属的性质、重金属实际污染量以及当时的环境条件状况等都会影响重金属对生态环境的安全性[13]。本研究中测定的3种重金属离子中除Mn2+对大型溞的毒性为低毒级以外, 其他离子对大型溞均表现出不同等级的毒性, 可见重金属离子对水体环境产生影响, 进而对大型溞产生较强的毒性效应。本试验测定了3种重金属在实验室条件下对大型溞的急性毒性水平, 反映了3种重金属以单一形态存在于环境条件下对水环境生态系统产生的急性毒性和环境效应。而在自然生态环境中, 重金属等污染物往往是以复合形态存在的, 对自然界造成复合污染。因此, 应加强重金属等污染物对生态环境的联合毒力效应、亚慢性和慢性毒性的风险等方面的研究, 为全面评价其对生态环境的危害风险控制提供基础数据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|