作者简介:胡霭臻(1995—),女,在读硕士,研究方向为水生动物营养及健康养殖,E-mail: 1239762918@qq.com
为确定导致棘胸蛙烂皮病的病原菌及其防治方法,从病死的棘胸蛙头部、腿部和肝部分离得到3株病原菌,分别命名为LJ10201、LJ10202、LJ10203。经形态学观察、生理生化实验、16S rDNA基因序列测定及系统发育学分析鉴定,确认LJ10201、LJ10203菌株为弗氏柠檬酸杆菌, LJ10202菌株为布氏柠檬酸杆菌,分离得到的菌株感染健康棘胸蛙可使棘胸蛙出现烂皮病症状。分离得到的LJ10201菌株对新霉素、头孢拉定(先锋Ⅵ)等9种药物敏感,LJ10202菌株对头孢拉定(先锋Ⅵ)、氯霉素敏感,菌株LJ10203对新霉素、阿奇霉素等8种药物敏感。本研究为棘胸蛙柠檬酸杆菌的分离鉴定及防治提供了理论基础。
棘胸蛙(Quasipaa spinose), 又称石蛙或石鸡, 属于两栖纲、无尾目、蛙科, 是我国独有的野生大型蛙类[1]。棘胸蛙肉质细腻香滑, 富含18种氨基酸, 食用价值和药用价值高, 被誉为“ 百蛙之王” [2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13]。随着野生棘胸蛙的过度捕捞和生存环境急剧恶化, 野生棘胸蛙数量明显下降, 2012年被列入“ 世界自然保护联盟” (IUCN)濒危物种红色名录, 属易危物种。本研究通过对患病蛙和健康蛙的对照实验, 以期为棘胸蛙柠檬酸杆菌的分离鉴定及防治提供建议。
1.1.1 供试蛙
患病棘胸蛙采自金华某棘胸蛙养殖基地, 平均体重(120± 8.5)g; 健康棘胸蛙均购自金华李骏棘胸蛙养殖基地, 平均体重(50± 4.3)g。
1.1.2 主要试剂
DNA提取试剂盒购自北京康为世纪生物科技有限公司; PCR引物购自生工生物工程(上海)股份有限公司; Taq酶、PCR Master Mix和DL 2000 DNA Marker均购自克劳宁(北京)生物科技有限公司。
1.2.1 病原菌分离
在无菌操作台内取患病棘胸蛙的头部、腿部和肝组织, 接种于普通琼脂培养基上, 32 ℃培养24 h, 观察病原菌的生长情况及菌落特征。选取长势良好的单一菌落进行纯培养, 分别命名为LJ10201、LJ10202、LJ10203。革兰氏染色观察病原菌的形态、结构和特征。
1.2.2 人工感染试验
取纯化后的菌株分别接种于LB液体培养基, 培养24 h后5 000 r· min-1离心1 min, 用无菌PBS离心洗涤2次, 调整菌悬液浓度至1× 107 mL-1。取健康棘胸蛙48只, 随机分成4组, 每组12只。采用腹腔注射法, 分别注射0.1 mL LJ10201、LJ10202、LJ10203菌株的菌悬液, 对照组腹腔注射0.1 mL无菌PBS。定期换水, 保持水质清新, 于实验室人工饲养10 d, 每天观察并记录组棘胸蛙的患病与死亡情况。
1.2.3 生理生化特性鉴定
使用梅里埃VITEK 2 Compact 全自动细菌鉴定仪鉴定生理生化指标。
1.2.4 16S rDNA基因序列分析及系统发育树构建
用DNA提取试剂盒分别提取纯培养的LJ10201、LJ10202、LJ10203病原菌DNA。上游引物为5'-AGAGTTTGATCCTGGCTCAG-3', 下游引物为5'-ACGGCTACCTTGTTACGACTT-3'。25 μ L PCR反应体系为ddH2O 9.5 μ L, 上下游引物各1.0 μ L, 模板1.0 μ L, 10× buffer、dNTP及Taq酶混合溶液12.5 μ L。采用的PCR反应条件为94 ℃预变性4 min; 94 ℃ 1 min, 49~54 ℃(12个温度梯度)1 min, 72 ℃ 1 min, 30个循环; 72 ℃延伸10 min, 所得产物电泳后观察。PCR产物进行测序, 并对分离得到的3株病原菌16S rDNA序列进行系统发育学分析。
1.2.5 药敏特性分析
病原菌于恒温培养箱培养24 h后, 挑取长势良好的单菌落接种在LB液体培养基上, 通过平板计数法和McFarland比浊法调整菌悬液浓度至1× 107 mL-1。用无菌移液管量取100 μ L菌悬液于普通琼脂培养基, 涂布均匀。采用标准纸片琼脂扩散法检测, 观察并记录各组抑菌圈的大小, 根据抑菌圈大小判断其药物敏感性。
从患病棘胸蛙头部、腿部和肝部分离得到的病原菌LJ10201、LJ10202、LJ10203菌株在普通琼脂培养基上的菌落形态均为:乳白色, 不透明或半透明, 凸起, 边缘光滑整齐, 恒温培养24 h后菌落直径为1.0~3.0 mm。挑取单菌落, 革兰氏染色, 置于普通光学显微镜下镜检, 发现3株病原菌均为革兰氏阴性菌, 呈杆状或短杆状, 无芽孢, 无荚膜。
用分离得到的病原菌感染健康的棘胸蛙72 h后, 棘胸蛙出现发病症状, 症状表现为:头部出现白斑, 从吻部开始表皮溃烂至向全身蔓延并逐渐脱落, 肌肉露出, 摄食活动减弱, 腹部肿大, 运动减弱, 个体表现呆滞。感染96 h后, 棘胸蛙出现死亡现象。感染8 d后, 3个试验组的棘胸蛙全部死亡, 对照组生长状况良好。解剖病死蛙发现, 其腹部有不同程度的积水, 内脏呈点状出血, 胃及肠道内无食物或少有食物, 并伴有肠道轻度糜烂等症状, 与原发病棘胸蛙表现症状相同且病理变化相似。在病死蛙的肝、肾等处分离得到与LJ10201、LJ10202、LJ10203菌株菌落形态相似、生理生化特征一致的菌株, 说明本试验中分离得到的3株LJ10201、LJ10202、LJ10203菌株为致病菌株。
根据《伯杰氏细菌鉴定手册》, 运用微生物全自动分析仪对3株病原菌进行生理生化检测菌株检测结果见表1。结果表明, LJ10201、LJ10203菌株各项生理生化检测结果与弗氏柠檬酸杆菌相符合, 初步判定其为弗氏柠檬酸杆菌; LJ10202菌株各项生理生化指标与布氏柠檬酸杆菌相符合, 初步将其判定为布氏柠檬酸杆菌。
| 表1 菌株生理生化特征 |
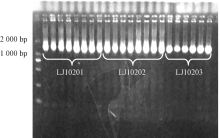
分别以LJ10201、LJ10202、LJ10203菌株DNA为模板进行16S rDNA扩增, 电泳检测扩增产物, 长度约为1 500 bp(图1)。送检测序后, 与Gene bank中的序列进行对比, 发现LJ10201和LJ10203菌株的16S rDNA基因序列与弗氏柠檬酸杆菌标准株(KF535108.1、KF145194.1)的同源性高达99%, LJ10202菌株的16S rDNA基因序列与布氏柠檬酸杆菌标准菌株(KC139411.1)的同源性高达99%。
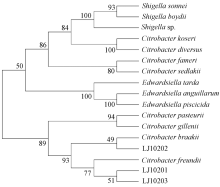
选取弗氏柠檬酸杆菌、布氏柠檬酸杆菌和肠杆菌科不同属的菌种部分16S rDNA序列构建系统发育树(图2)。
研究发现, 从患病棘胸蛙头部分离得到的LJ10201菌株对强力霉素、新霉素、头孢他啶、氯霉素、头孢拉定(先锋Ⅵ )、链霉素、恩诺沙星、阿莫西林、庆大霉素敏感, 对阿奇霉素、罗红霉素中度敏感, 对复方新诺明、红霉素、克拉霉素、万古霉素、利福平、青霉素、卡那霉素不敏感。从病蛙腿部分离得到的LJ10202菌株对头孢拉定(先锋Ⅵ )、氯霉素敏感, 对新霉素、克拉霉素、万古霉素、罗红霉素中度敏感, 对复方新诺明、红霉素、阿莫西林、阿奇霉素、强力霉素、利福平、青霉素、头孢他啶、链霉素、恩诺沙星、卡那霉素、庆大霉素不敏感。从病蛙肝部分离得到的LJ10203菌株对强力霉素、头孢他啶、阿奇霉素、链霉素、恩诺沙星、新霉素、卡那霉素、庆大霉素敏感, 对克拉霉素中度敏感, 对复方新诺明、红霉素、头孢拉定(先锋Ⅵ )、阿莫西林、万古霉素、利福平、青霉素、罗红霉素、氯霉素不敏感(表2)。
| 表2 LJ10201、LJ10202、LJ10203菌株药敏试验结果 |
本实验中, 各菌株的药物敏感性与已报道的弗氏柠檬酸杆菌的耐药性有一定差异, 各菌株之间的药物敏感性也存在差异, 这可能与分离方法或菌株来源不同有关。研究发现, 柠檬酸杆菌对红霉素、青霉素、利福平等常用药物已产生耐药性, 但由于个体生活环境等的差异, 不同来源的菌株之间耐药性仍有差异。因此, 在水产养殖过程中, 要针对病原菌合理用药, 外用兼内服抗生素药物, 结合多维补充, 提高机体免疫力, 加快创口愈合, 才能达到良好的治疗效果, 并减缓柠檬酸杆菌耐药性的形成。
通过无菌操作分离得到棘胸蛙烂皮病的病原菌, 经细菌形态、生理生化鉴定、16S rDNA基因序列同源性分析和人工感染试验, 证实病原菌LJ10201、LJ10203为弗氏柠檬酸杆菌, LJ10202为布氏柠檬酸杆菌。弗氏柠檬酸杆菌和布氏柠檬酸杆菌广泛分布于土壤、水体和动物体内, 可引起人兽共患疾病。EWERS等[14]发现狗、猫和马可感染弗氏柠檬酸杆菌, 引起炎症、败血症甚至急性死亡, 刘广义等[15]从患者体内分离得到了156株弗氏柠檬酸杆菌, YANAGAWA等[16]、MINJEONG等[17]分别从临床感染的患者体内分离得到病原菌柠檬酸杆菌。
近年来, 有关柠檬酸杆菌感染水生动物的报道日渐增多。王家祯等[8]发现青鱼感染弗氏柠檬酸杆菌后出现体表发黑、粘液增多、肛门红肿、腹部有出血点等症状, 解剖发现其腹腔积水, 肝、脾肿大, 肠道发炎并出血, 从病鱼肝脏中可分离得到弗氏柠檬酸杆菌。肖宁等[18]从濒死的克氏原螯虾肝胰腺中分离得到弗氏柠檬酸杆菌, 曹正娇[12]和高正勇等[19]从患病的大鲵中分离得到了弗氏柠檬酸杆菌。水生动物易感染柠檬酸杆菌可能与水生动物生存环境有关, 水体中的柠檬酸杆菌可由水生动物伤口或经口摄食而大量进入体内, 引发疾病, 且在水中细菌性疾病蔓延速度极快, 往往引起个体大量死亡[20]。因此, 在水产养殖中, 养殖人员要做好预防措施, 尤其在大雨过后, 要注意监测水质, 保持水质清新, 严防因雨水冲刷而大量进入水体中的柠檬酸杆菌感染水产动物, 引发大面积死亡。
本研究中, 以浓度1× 108 mL-1病原菌感染健康棘胸蛙, 9 d后棘胸蛙死亡率达到100%, 可见柠檬酸杆菌对棘胸蛙有较高的致病性。已有研究表明, 柠檬酸杆菌的致病性与其脂多糖结构、致病基因和耐药基因有较大关系。严玉霖等[21]研究发现, 内毒素为脂多糖中的主要毒力成分, 可在细菌溶解或活跃繁殖时释放, 并引起宿主免疫应答, 危害人畜健康。周加利[22]发现, 弗氏柠檬酸杆菌脂多糖中的O抗原种类对人和动物有很强的感染力, 并且对内毒素的毒力作用有调控能力。白莉[23]在研究中发现, 弗氏柠檬酸杆菌可能带有编码OmpX-sfaABC-铁转运系统等毒力岛, 对其致病性有极大影响。阎斌伦等[24, 25, 26, 27, 28]研究表明, 弗氏柠檬酸杆菌引起腹泻的主要原因可能是携带有定居因子抗原cfa基因。但细菌的致病基因与其致病性之间的作用机制仍然不清楚, 确定致病基因的作用机理将是今后研究的热点。
目前对棘胸蛙柠檬酸杆菌的防治方法主要停留在预防为主的阶段, 如有感染即选用常用抗生素进行治疗, 但已有研究表明柠檬酸杆菌已对某些药物产生耐药性[29, 30, 31, 32], 且另有研究表明其毒力有加强的趋势[33, 34]。长此以往, 传统药物的治疗未必能达到较好的疗效。因此, 今后应当加强对细菌黏附、胞外酶产物、致病基因和耐药基因的研究, 尤其是对强毒力菌株的研究, 如致病基因与致病性之间的关系、耐药基因的作用机理等, 以期研发能够针对性地遏制病原菌黏附, 阻断致病基因或耐药基因传递、表达的抗细菌毒力的新型药物。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|