作者简介:李文娴(1981—),女,河南长垣人,硕士在读,主要从事兽医病原学研究。
为探讨河南省部分规模化猪场仔猪败血症病原,采用涂片镜检、细菌分离培养、生化试验、药敏试验、动物试验等方法对采集的病料进行研究。结果表明,从疑似猪链球菌2型感染猪的器官中分离得到了8株猪链球菌,经PCR鉴定及核苷酸同源性比较发现,这8株猪链球菌与猪链球菌2型的毒力因子序列同源性高达97%。动物试验证实,分离到的菌株能复制出与自然发病猪相同的临床症状。分离的菌株对青霉素、阿莫西林、恩诺沙星高度敏感,对四环素、庆大霉素、林可霉素耐药。研究结果表明,河南地区猪链球菌2型的耐药谱越来越广,耐药性也越来越强。
猪链球菌(Streptococcus suis)是一种重要的细菌性猪源病原体, 可引起猪败血症、脑膜炎等症状。根据荚膜抗原的不同, 猪链球菌可以分为35个血清型, 根据毒力不同可被分为高度致病性、低致病性和非致病性。猪链球菌2型是致病性最强的猪链球菌, 可从临床患病的仔猪中分离获得[1, 2, 3]。猪链球菌2型是一种重要的人兽共患病原菌[4, 5], Yanase等[6]从日本1名患有脑膜炎和化脓性脑室炎的肉类批发商的血液和脑脊液中分离到猪链球菌2型, Gomez-Torres等[7, 8]报告了1例加拿大的猪链球菌人类疾病, 分离的菌株是血清型2型, 基因型上与北美猪中分离到的菌株相近。
猪链球菌病分布范围广, 自1954年在英国首次报道以来, 荷兰、英国、法国、美国等国家均有报道。1958年, 我国首次发现该病, 20世纪70~80年代发病日趋严重, 在许多地区呈地方性流行、大群爆发。1998年和2005年, 我国曾2次爆发猪链球菌病, 造成万余头猪死亡, 52人死亡[9]。目前, 我国多个地区不断有人感染猪链球菌的报道, 已严重影响了我国养猪业的发展和人类健康[10, 11, 12]。
本试验从河南不同规模化猪场发生败血症的仔猪中采集肝、脾、肾等脏器, 采用涂片镜检、细菌分离培养、生化试验、药敏试验、动物试验等方法对采集的病料进行研究。
1.1.1 病料
采集2009— 2011年临床发病猪的肝、脾、肾、肺、脑、关节液和皮下脓肿物样品, 于-20 ℃保存备用。
1.1.2 标准菌株及试验动物
猪链球菌2型无毒株1330购自中国兽药监察所; 无链球菌感染的仔猪由河南辉县现代化养殖场提供。
1.1.3 主要试剂
普通琼脂平板、血琼脂平板、血清肉汤培养基参照参考文献[12]制备; 生化试验所用试剂购自济南根博生物有限公司; 生化鉴定管、氨苄青霉素、阿莫西林、恩诺沙星、克林霉素等药敏纸片购自杭州天和微生物试剂有限公司; 细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司; LA Taq、dNTP、DNA Marker DL2000购自大连宝生物工程有限公司。
1.1.4 主要仪器
移液器购自德国Eppendorf公司; 超净工作台购自苏州净化设备厂; 高压灭菌器购自北京勤诚盛达科学仪器有限公司; PCR仪购自美国BIO-RAD公司; 凝胶成像系统购自英国Syngene公司。
1.2.1 病料镜检
在超净工作台里, 采集发病猪的心血涂片及脾、肝、肺、淋巴结等组织脏器触片或涂片, 经干燥、固定、革兰染色、染色区域风干后, 在油镜下观察染色情况和形态特征。
1.2.2 猪链球菌的分离培养
将无菌采集的发病猪的脏器接种于血琼脂平板上, 室温放置3~5 min, 倒置于37 ℃培养箱中培养24 h, 观察菌落的形态和变化趋势。挑取疑似阳性的菌落, 进行染色镜检, 观察其是否形成短链排列的菌落形态。将镜检阳性的菌株进行纯化培养, 最终经染色镜检无杂菌的细菌保存, 并利用平板表面涂布法记数菌落总数, 稀释至合适浓度备用。
1.2.3 PCR鉴定
依据GenBank中发表的Streptococcus suis GDH基因序列(AB246887.1), 利用Primer 5.0设计1对鉴定引物, 由北京擎科新业生物技术有限公司合成。上游引物:5'-CATGAAACAGAATTCCTCCAA GC-3'; 下游引物:5'-GTATTGACCGTACATGTAAC CGA-3'。以分离菌株的基因组DNA作为模板, 利用合成的引物进行PCR扩增, 片段长度约为500 bp。
1.2.4 生化特性分析
利用微量发酵管, 将菌液接种于甘露醇、山梨醇、乳糖、葡萄糖、麦芽糖、肝糖、肌醇、木胶糖、硫化氢、蔗糖、VP等发酵管中, 37 ℃培养箱中培养24 h, 观察。
1.2.5 药敏试验
采用纸片扩散法测定分离株对临床常用抗菌药物的敏感性。将分离株通过划线、挑取单克隆进行培养。菌液利用生理盐水进行稀释后, 终浓度为1× 105 mL-1, 将其接种在血琼脂平板上(0.2 mL· L-1)。在培养基表面放置药敏片, 两片之间的距离以1~2 cm为宜, 置于37 ℃恒温箱中培养18~24 h, 测量抑菌圈直径, 分析分离株对各药物的敏感性。
1.2.6 动物致病性试验
选取健康仔猪20头, 随机分成2组, 每组10头。试验组静脉注射分离株菌液2 mL(接种量为6× 107头-1), 对照组静脉注射等体积的生理盐水。观察并记录动物的临床表现, 及时解剖死亡猪并记录病理变化, 28 d后扑杀所有猪, 剖检并记录。无菌采集死亡和剖检的试验猪的心肌、肝脏、脾脏、肺脏和肾脏进行细菌分离, 用PCR方法鉴定分离菌株, 并判定分离株对试验猪的致病力。
分离菌株在血琼脂培养基上生长良好, 可见中等大小的菌落, 该菌落呈圆形、透明, 且中央隆起、边缘整齐, 带有溶血环。挑取单个菌落进行镜检, 具有成对或短链状的细菌形态。
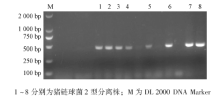
以分离株基因组DNA为模板, 应用猪链球菌2型GDH基因特异性引物进行PCR扩增(图2)。将检测阳性的分离株进一步测序, 发现与猪链球菌2型的GDH基因序列的同源性达97%。
结果显示, 试验猪体温高、呼吸困难, 分泌的鼻液呈浆液状。试验猪死亡8头, 对照正常。剖检死亡猪, 可见肺、肝脏、心、脾各脏器出血, 全身淋巴结水肿。在超净工作台上采集死亡猪和对照的心、肝等器官进行细菌分离, 试验组可检测到链球菌的存在, 对照组中未分离到细菌。
猪链球菌是革兰氏阳性兼性厌氧球菌, 在35种血清型中, 2型猪链球菌是一种流行的强毒株。
对猪链球菌2型的进一步分子分析, 包括基因组测序、结构生物学和蛋白质组学等, 有助于了解其作用机制, 并为畜牧生产提供依据。
抗生素在农业生产中具有非常重要的作用, 有利于抑制动物消化道内有害细菌的增殖, 减少不必要的营养消耗, 节约饲料, 增强抗病力等。随着抗生素的广泛应用, 细菌的耐药性已成为全球的公共卫生问题。谨慎使用抗菌素, 对于保持广谱抗菌剂的治疗功效和减少耐药型猪链球菌菌株的选择至关重要。本研究采用纸片扩散法对所分离的猪链球菌进行了耐药性研究, 研究发现, 分离株对猪场常用的抗菌药物(如链霉素、庆大霉素、四环素等)产生了不同程度的耐药性, 表明饲养过程中这些药物的长期使用已促使菌株产生了耐药性。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|