作者简介:汪雷(1989—),男,河南信阳人,硕士研究生,从事植物生理学方面的研究工作,E-mail:1157130668@qq.com。
槲皮素是一种具有多种生物活性的黄酮类化合物。以槲皮素为先导物,选择性地对C环3位羟基进行结构修饰。以廉价的芦丁为原料,经苄基化保护、酸水解得到中间体1(7,3',4'-氧-三苄基槲皮素),中间体1与羧酸发生Steglich酯化反应,再经Pd/C催化加氢脱苄基得到7种槲皮素-3-氧-酰基酯,目标产物结构经红外光谱(IR)、1H核磁共振(NMR)、13C NMR、电喷雾-质谱(ESI-MS)确证。采用邻二氮菲法和DPPH法考查7种目标化合物的抗氧化活性,结果显示,槲皮素3位羟基以2~3个碳原子的羧酸取代能提高其抗氧化活性。采用MTT法初步评价了7种目标化合物对人食管癌细胞(EC109)、人食管鳞癌细胞(EC9706)、人胃癌细胞(MGC-803)和人前列腺癌细胞(PC-3)的抑制作用。结果表明,槲皮素3位羟基以7个碳原子以上羧酸取代能显著提高其对MGC-803细胞的抑制作用。
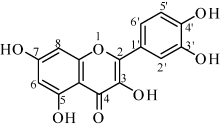
槲皮素(3, 3', 4', 5, 7-五羟基黄酮)是一种黄酮醇类化合物, 广泛存在于洋葱、苹果、槐米等植物中[1, 2, 3, 4]。槲皮素具有抗氧化[5]、抗炎[6]、舒张血管[7]、降血压[8]、抗肿瘤[9, 10, 11]等多种生物活性, 其抗肿瘤活性现已成为国内外研究的热点[12]。然而, 槲皮素口服的生物利用度较低。作为一种先导化合物, 对槲皮素进行结构修饰, 可得到许多高活性的槲皮素衍生物, 槲皮素酯就是其中重要的一类[13]。槲皮素属于多官能团化合物, 存在多个可以修饰的位点, 本文重点讨论其3位羟基的修饰。
Domingo等[14]合成的槲皮素-3-氧-乙酰酯、Saija等[15]合成的槲皮素-3-丙酸酯等酯类化合物, 均具有较好的抗氧化性和光保护性, 可以作为光保护剂的候选化合物。与母核槲皮素相比, 槲皮素3位用短链取代能改善其水溶性。Gatto等[16]合成了8个槲皮素-3-氧-酰酯衍生物。与槲皮素相比, 槲皮素-3-氧-酰基酯类衍生物抗酯酶活性要高, 且具有较好的药代动力学特性, 是一种潜在的新型抗菌药。此外, 槲皮素3位酯化修饰产物可以成为槲皮素的前药。Montenegro等[17]对槲皮素3位进行酯化修饰, 其中2个槲皮素3位酰酯类衍生物具有合适的脂/水分配系数, 在水中稳定, 能迅速被酶水解释放出槲皮素, 是一种新型槲皮素前药。Thapa等[18]合成了槲皮素-3-氧-没食子酸酯, 具有抵抗流感A型病毒的活性。与槲皮素相比, 槲皮素3位以N, N-二甲基氨基甲酰基取代, 其水溶性增强14倍, 且不易发生非酶水解, 是一种新型的槲皮素前药[19]。Huang等[20]对槲皮素3-位羟基进行氨基酸酯化修饰, 得到15种槲皮素-3-氧-氨基酸酯, 能高选择性地抑制酪氨酸激酶。Fraisse等[21]合成的槲皮素-3-氧-苯基异氰酸酯, 能有效抑制慢性骨髓白血病细胞K562和结肠癌细胞CT26的增殖, 药效分别是槲皮素的73倍和308倍。
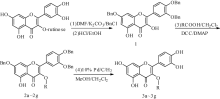
本研究以芦丁为原料, 以苄氯对其7位、3'位和4'位(图1)羟基进行苄基化保护, 然后在酸性醇溶液中水解脱去芦丁糖, 得到中间体1(7, 3', 4'-氧-三苄基槲皮素), 中间体1与羧酸发生Steglich酯化反应, 进一步脱去苄基后得到槲皮素酯类衍生物, 共合成得到7个目标化合物, 其结构经核磁、质谱确证。通过抗氧化和抗肿瘤活性试验, 从中筛选出活性优于槲皮素的化合物, 并对构效关系作初步总结。
UV2550紫外-可见分光光度计, 日本岛津; iS10 FT-IR红外光谱仪, 美国尼高力; 400 MHz核磁共振仪, 美国Brucker; Esquire3000质谱仪, 美国Brucker; RE-52AA型旋转蒸发仪, 上海亚荣生化仪器厂。
槲皮素、芦丁, 河南平舆馨星生化有限公司。氯化苄, 重蒸供用。二氯甲烷, 加入氢化钙回流2 h, 蒸馏, 密封备用。1, 1-二苯-2-苦基肼(DPPH), 上海晶纯试剂有限公司; 邻二氮菲, 天津市化学试剂三厂。所用试剂和溶剂均为分析纯。
1.2.1 清除羟基自由基
按文献[22]方法, 有所修改。损伤管的加样顺序如下:在10 mL具塞试管中依次加入1 mL 0.75 mmol· L-1邻二氮菲水溶液、2 mL 0.15 mol· L-1磷酸盐缓冲液(pH值7.4)和0.5 mL蒸馏水, 混匀。然后加入新鲜配制的0.75 mmol· L-1的FeSO4溶液1 mL, 混匀, 再加入0.01%的过氧化氢1 mL, 37 ℃水浴保温60 min后, 在536 nm测吸光值(D0)。样品管加样顺序同上所述, 仅以0.5 mL供试液替代损伤管中的蒸馏水, 在536 nm处测吸光值(D1)。未损伤管加样顺序同样品管, 但以1 mL蒸馏水代替损伤管中0.01%过氧化氢, 于536 nm处测吸光值(D2)。以槲皮素为阳性对照。计算自由基清除率(ROH)及自由基半数清除率(SC50)。
ROH=100(D1— D0)/(D2— D0)。
1.2.2 清除DPPH自由基
参照文献[23]方法, 在5 mL具塞试管中加入供试液1 mL, 再加入3 mL 0.1 mmol· L-1的DPPH溶液, 摇匀, 避光放置30 min, 在517 nm处测吸光值Dy。空白对照组加样顺序同上, 仅以1 mL无水乙醇替代供试液, 测吸光值为Ds, 供试液组加样顺序同上, 仅以3 mL无水乙醇溶液替代DPPH溶液, 测吸光值为DT, 计算DPPH自由基清除率(RDPPH)及SC50。
RDPPH=100[1— (Dy— DT)/Ds]。
1.2.3 细胞试验
用MTT法检测不同浓度槲皮素及其酯类化合物对EC109细胞、MGC-803细胞、EC9706细胞、PC-3细胞增殖的抑制作用。取对数生长期细胞, 接种于96孔培养板中, 每孔200 μ L, 置于体积分数5% CO2、饱和湿度37 ℃的培养箱中培养。待细胞贴壁, 试验组加入RPMI1640培养基稀释的槲皮素酯类衍生物至终浓度分别为0.5、1、2、4、8、16、32、64、128 μ g· mL-1, 溶剂对照组中加入培养基, 每孔终体积为200 μ L, 每组设6个复孔。72 h后, 取出培养板于倒置显微镜下进行形态学观察并拍照。每孔再加入20 μ L 5 mg· mL-1 MTT继续培养4 h, 弃去原培养液后, 用PBS清洗每孔, 每孔各加入150 μ L DMSO, 晃匀使沉淀溶解, 室温下静置约20 min(溶液呈紫红色), 将96孔板置于酶标仪上在492 nm波长处测各孔光密度值, 计算各组的生长抑制率及半抑制浓度(IC50)。
1.3.1 中间体1(7, 3', 4'-氧-三苄基槲皮素)的合成
按文献[24]的方法, 有所改进。取芦丁2.44 g(4.0 mmol)溶于20 mL 二甲基甲酰胺(DMF)中, 加入1.93 g(14.0 mmol)无水碳酸钾和催化剂碘化钾搅拌, 冰浴条件下, 缓慢滴加1.6 mL(14.0 mmol)新蒸馏的氯化苄, 缓慢升温至室温, 搅拌过夜(约12 h), TLC监测反应。待反应完全, 加入冰醋酸将反应液调至pH值6, 再向其中加入200 mL蒸馏水, 有大量沉淀析出, 继续搅拌1 h后, 沉淀聚集于瓶底, 弃去上清液。向沉淀中加入60 mL 95%乙醇, 水浴加热至固体完全溶解, 一次性加入10 mL浓盐酸, 加热回流, 15 min后开始有黄色沉淀产生, 1 h后反应结束。冷却, 冰箱放置过夜, 过滤, 烘干, 得粗品, 用三氯甲烷/甲醇重结晶, 干燥, 得到黄色固体, 产率78%。熔点(M.p):188.3~190.1 ℃(文献值188~190 ℃[24])。1H核磁共振(1H NMR)(400 MHz, DMSO)δ 12.42 (s, 1H, 5-OH), 9.72 (s, 1H, 3-OH), 7.90 (s, 1H, 2'-H), 7.85 (d, J=8.7 Hz, 1H, 6'-H), 7.32~7.40 (m, 15H, 3× OCH2C6H5), 7.25 (d, J=8.7 Hz, 1H, 5'-H), 6.67 (d, J=2.1 Hz, 1H, 8-H), 6.26 (d, J=2.1 Hz, 1H, 6-H), 5.21 (s, 4H, 2× OCH2C6H5), 5.11 (s, 2H, OCH2C6H5)。红外光谱(IR)(KBr):3 290、1 651、1 616、1 593、1 504、1 455、1 306、1 258、997、749 cm-1。
1.3.2 槲皮素酯类衍生物(3)的合成
槲皮素-3-氧-乙酸酯(3a)的制备。取7, 3', 4'-氧-三苄基槲皮素-3-氧-乙酸酯0.614 g(2.0 mmol)溶于二氯甲烷/甲醇混合溶剂中, 加入Pd/C(浓度为10%)催化剂0.159 g, 室温0.4 MPa压力条件下, 加氢反应6 h, TLC监测反应。反应结束后, 过滤, 滤除Pd/C, 滤液减压蒸馏回收溶剂, 得到固体, 以氯仿-甲醇(体积比20: 1)为洗脱剂, 过硅胶柱, 得到淡黄色固体, 产率60.0%。M.p:196.6~198.2 ℃。电喷雾-质谱(ESI-MS):343 [M-H]+。1H NMR (400 MHz, DMSO) δ 12.23 (s, 1H, 5-OH), 10.78 (s, 1H, 7-OH), 9.77 (s, 2H, 3'-OH, 4'-OH), 7.35 (d, J=2.2 Hz, 1H, 2'-H), 7.29 (dd, J=8.4, 2.2 Hz, 1H, 6'-H), 6.93 (d, J=8.4 Hz, 1H, 5'-H), 6.48 (d, J=1.9 Hz, 1H, 8-H), 6.25 (d, J=1.9 Hz, 1H, 6-H), 2.35 (s, 3H, CH3CO)。13C NMR (101 MHz, DMSO) δ 175.37, 168.49, 165.12, 161.52, 157.05, 156.33, 149.78, 145.95, 130.05, 120.98, 120.06, 116.49, 115.39, 103.89, 99.53, 94.54, 20.78。IR(KBr):3 327、1 753、1 651、1 602、1 567、1 489、1 357、1 306、1 183、939、793 cm-1。
槲皮素-3-氧-丙酸酯(3b)的制备。制备方法同3a。3b为黄色固体, 产率46.0%。M.p:193.7~195.4 ℃。ESI-MS:357.0 [M-H]+, 381.1 [M+Na]+。1H NMR (400 MHz, DMSO) δ 12.22 (s, 1H, 5-OH), 11.04 (s, 1H, 7-OH), 9.96 (s, 1H, 3'-OH), 9.65 (s, 1H, 4'-OH), 7.33 (d, J=2.2 Hz, 1H, 2'-H), 7.28 (dd, J=8.4, 2.2 Hz, 1H, 6'-H), 6.92 (d, J=8.4 Hz, 1H, 5-H), 6.48 (d, J=2.0 Hz, 1H, 8-H), 6.25 (d, J=2.0 Hz, 1H, 6-H), 2.68 (q, J=7.5 Hz, 2H, CH2COO), 1.15 (t, J=7.5 Hz, 3H, CH3)。13C NMR (101 MHz, MeOD) δ 175.78, 172.06, 164.84, 161.58, 157.19, 156.88, 148.95, 145.18, 129.98, 120.81, 120.58, 115.12, 114.77, 103.84, 98.81, 93.73, 26.68, 7.85。IR(KBr):3 476、3 127、1 756、1 654、1 604、1 513、1 454、1 367、1 286、1 194、1 086、792 cm-1。
槲皮素-3-氧-丁酸酯(3c)的制备。制备方法同3a。3c为黄色固体, 产率62%。M.p:206.6~208.5 ℃。ESI-MS:373.1 [M+H]+, 395.1 [M+Na]+。1H NMR (400 MHz, DMSO) δ 12.24 (s, 1H, 5-OH), 11.02 (s, 1H, 7-OH), 9.91 (s, 1H, 3'-OH), 9.55 (s, 1H, 4'-OH), 7.33 (d, J=1.3 Hz, 1H, 2'-H), 7.27 (dd, J=8.4, 2.2 Hz, 1H, 6'-H), 6.91 (d, J=8.4 Hz, 1H, 5'-H), 6.48 (d, J=2.0 Hz, 1H, 8-H), 6.25 (d, J=2.0 Hz, 1H, 6-H), 2.63 (t, J=7.2 Hz, 2H, CH2COO), 1.66 (dd, J=14.6, 7.3 Hz, 2H, CH2CH2COO), 0.95 (t, J=7.4 Hz, 3H, CH3CH2CH2COO)。13C NMR (101 MHz, DMSO) δ 175.41, 170.91, 165.07, 161.55, 157.06, 156.46, 149.72, 145.93, 130.03, 120.98, 120.09, 116.39, 115.48, 103.92, 99.51, 94.53, 35.41, 18.33, 13.77。IR(KBr):3 372、3 073、2 968、2 878、1 750、1 735、1 597、1 533、1 449、1 377、1 295、1 197、993、846、603 cm-1。
槲皮素-3-氧-戊酸酯(3d)的制备。制备方法同3a。3d为黄色固体, 产率62.5%。M.p:209.6~211.5 ℃。ESI-MS:385.0 [M-H]+。1H NMR (400 MHz, DMSO) δ 12.23 (s, 1H, 5-OH), 11.03 (s, 1H, 7-OH), 9.91 (s, 1H. 3'-OH), 9.54 (s, 1H, 4'-OH), 7.32 (d, J=2.2 Hz, 1H, 2'-H), 7.26 (dd, J=8.4, 2.2 Hz, 1H, 6'-H), 6.91 (d, J=8.4 Hz, 1H, 5'-H), 6.48 (d, J=2.0 Hz, 1H, 8-H), 6.25 (d, J=2.0 Hz, 1H, 6-H), 2.64 (t, J=7.3 Hz, 2H, CH2COO), 1.68~1.56 (m, 2H, CH2CH2COO), 1.35 (dd, J=15.0, 7.5 Hz, 2H, CH2CH2CH2COO), 0.89 (t, J=7.3 Hz, 3H, CH3CH2CH2CH2COO)。13C NMR (101 MHz, DMSO) δ 175.41, 171.02, 165.07, 161.54, 157.06, 156.48, 149.72, 145.93, 130.03, 120.98, 120.07, 116.37, 115.48, 103.92, 99.51, 94.53, 33.28, 26.85, 21.93, 14.04。IR(KBr):3 416、3 301、2 961、2 864、1 748、1 659、1 614、1 513、1 444、1 358、1 239、1 196、1 002、850、594 cm-1。
槲皮素-3-氧-庚酸酯(3e)的制备。制备方法同3a。3e为黄色固体, 产率67.1%。M.p:195.9~197.1 ℃。ESI-MS:413.2 [M-H]+, 437.1 [M+Na]+。1H NMR (400 MHz, DMSO) δ 12.24 (s, 1H, 5-OH), 10.98 (s, 1H, 7-OH), 9.90 (s, 1H, 3'-OH), 9.56 (s, 1H, 4'-OH), 7.32 (d, J=2.1 Hz, 1H, 2'-H), 7.26 (dd, J=8.4, 2.1 Hz, 1H, 6'-H), 6.91 (d, J=8.4 Hz, 1H, 5'-H), 6.47 (d, J=1.9 Hz, 1H, 8-H), 6.25 (d, J=1.9 Hz, 1H, 6-H), 2.63 (t, J=7.3 Hz, 2H, CH2COO), 1.70~1.56 (m, 2H, CH2CH2COO), 1.36~1.17 [m, 6H, (CH2)3], 0.85 (t, J=6.6 Hz, 3H, CH3)。13C NMR (101 MHz, DMSO) δ 175.41, 171.02, 165.07, 161.55, 157.05, 156.48, 149.73, 145.93, 130.03, 120.98, 120.06, 116.33, 115.48, 103.92, 99.50, 94.52, 33.57, 31.33, 28.43, 24.74, 22.42, 14.33。IR(KBr):3 304、2 930、2 857、1 745、1 658、1 612、1 513、1 443、1 357、1 275、1 196、1 002、850 cm-1。
槲皮素-3-氧-壬酸酯(3f)的制备。制备方法同3a。3f为黄色固体, 产率60%。M.p:197.3~198.7 ℃。ESI-MS:441 [M-H]+, 443 [M+H]+; 1H NMR (400 MHz, DMSO) δ 12.25 (s, 1H, 5-OH), 10.95 (s, 1H, 7-OH), 9.96 (s, 1H, 3'-OH), 9.61 (s, 1H, 4'-OH), 7.33 (d, J=2.2 Hz, 1H, 2'-H), 7.26 (dd, J=8.4, 2.2 Hz, 1H, 6'-H), 6.91 (d, J=8.4 Hz, 1H, 5'-H), 6.47 (d, J=2.0 Hz, 1H, 6-H), 6.25 (d, J=2.0 Hz, 1H, 8-H), 2.63 (t, J=7.3 Hz, 2H, CH2COO), 1.70~1.56 (m, 2H, CH2CH2COO), 1.27 (dd, J=20.9, 9.8 Hz, 10H, (CH2)5), 0.84 (t, J=6.8 Hz, 3H, CH3)。13C NMR (101 MHz, DMSO) δ 175.41, 171.00, 165.08, 161.56, 157.05, 156.45, 149.74, 145.93, 130.04, 120.97, 120.06, 116.33, 115.46, 103.91, 99.50, 94.51, 33.57, 31.67, 29.08, 29.02, 28.76, 24.78, 22.55, 14.42。IR(KBr):3 415、3 302、2 926、2 855、1 746、1 659、1 614、1 513、1 444、1 359、1 240、1 196、1 002、851、668 cm-1。
槲皮素-3-氧-硬脂酸酯(3g)的制备。制备方法同3a。3g为黄色固体, 产率56.9%。M.p:208.3~210.6 ℃。ESI-MS:600 [M+H]+。1H NMR (400 MHz, DMSO) δ 12.24 (s, 1H, 5-OH), 10.98 (s, 1H, 7-OH), 9.83 (s, 1H, 3'-OH), 9.52 (s, 1H, 4'-OH), 7.33 (d, J=2.1 Hz, 1H, 2'-H), 7.26 (dd, J=8.4, 2.1 Hz, 1H, 6'-H), 6.90 (d, J=8.4 Hz, 1H, 5'-H), 6.47 (d, J=1.8 Hz, 1H, 8-H), 6.25 (d, J=1.8 Hz, 1H, 6-H), 2.62 (t, J=7.2 Hz, 2H, CH2COO), 1.62 (d, J=7.4 Hz, 2H, CH2CH2COO), 1.49~1.09 (m, 28H, 14× CH2), 0.83 (t, J=6.7 Hz, 3H, CH3)。13C NMR (101 MHz, DMSO) δ 175.41, 170.93, 165.08, 161.60, 157.05, 156.42, 149.74, 145.95, 130.08, 120.93, 120.10, 116.32, 115.47, 103.93, 99.49, 94.48, 33.60, 31.77, 29.54, 29.50, 29.41, 29.32, 29.20, 24.78, 22.56, 14.36。IR(KBr):3 395、2 981、2 904、1 719、1 682、1 606、1 527、1 440、1 367、1 288、1 182、846、771、700 cm-1。
相关研究[25]表明, 芦丁溶于DMF, 在加热条件下与氯化苄反应3 h, 薄层层析(TLC)显示有多个斑点, 且后处理过程中产生很多褐色的黏稠状固体。这可能是多元酚在碱性环境中加热, 发生了氧化或者聚合的副反应。虽然经过相关分离手段也得到了7, 3', 4'-氧-三苄基槲皮素, 但产率较低。在文献[26]的基础上, 改进试验条件:在室温下, 将芦丁溶于DMF, 加入3.5倍芦丁质量的氯化苄, 搅拌反应过夜。一方面, 可以避免原料自身的聚合反应; 另一方面, 低温不易破坏5-羟基与4-羰基形成的氢键, 使得最终产物以三保护为主, 存在少部分二保护产物。通过氯仿/甲醇重结晶, 得到较纯的中间体7, 3', 4'-氧-三苄基槲皮素。加入羧酸酯化得到图2中2a~2g, 催化氢解脱保护基得到目标产物(图2中3a~3g)。
从表1可知, 除化合物3f和3g外, 其余化合物在试验浓度下, 对羟基自由基的清除率均能达到70%以上, 且清除率随浓度增大呈明显上升趋势。从半数清除率(SC50)来看, 化合物3a和3b的SC50均小于282.5 μ mol· L-1, 低于母药槲皮素。并且发现槲皮素3位以4个碳以下的短链脂肪酸取代, 将有利于其活性增强。通过比较化合物3a~3g, 发现随着脂肪烃碳链的延长, 其清除羟基自由基的活性大体呈现出越来越差的趋势。
| 表1 不同浓度的槲皮素-3-O-酰基酯类化合物对羟基自由基的清除效果 |
从表2可知, 新合成的7个槲皮素酯类化合物除3g外, 对DPPH自由基均具有一定的清除效果, 并且呈现一定的量效关系。其中, 3a、3b、3c的SC50均小于槲皮素的18.8 μ mol· L-1。这表明以4个碳以下的脂肪酸取代槲皮素3位羟基, 有利于增强其清除DPPH自由基的能力。
| 表2 不同浓度的槲皮素-3-氧-酰基酯类化合物对DPPH自由基的清除率效果 |
槲皮素的抗氧化活性以B环上的邻二酚羟基活性最高。这是因为当B环羟基与自由基作用后, 产生的自由基可以借助形成分子内氢键得以稳定, 而且还可以通过共振形成苯醌, 从而降低内能, 提高稳定性。槲皮素酯类衍生物具有清除自由基活性的作用:一方面, 归因于槲皮素所具有的大π 键共轭体系; 另一方面, 由于对槲皮素3位进行结构修饰, 保留了槲皮素B环具有活性的儿茶酚结构, 引入的之类取代基, 能扩大整个分子的共轭体系, 从而稳定与自由基反应后生成的中间体, 因而抗氧化能力得到改善。
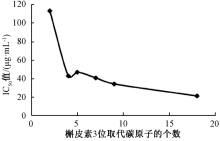
从表3可知, 槲皮素对EC109和EC9706细胞的抑制作用相对较好, 而对其他2种细胞的IC50值均大于128 μ g· mL-1。合成的7种槲皮素酯类衍生物对这4种癌细胞均有不同程度的抑制作用, 但总体来看, 普遍对人胃癌细胞MGC-803有较好的抑制作用。构效关系分析表明, 槲皮素3位以脂肪链取代时, 随着碳链延长, 其对EC109细胞的抑制效果增强(图3)。
| 表3 槲皮素-3-氧-酰基酯类化合物对不同肿瘤细胞的增殖抑制率 |
虽然新合成的7个槲皮素酯类化合物对于人食管癌细胞EC109的作用均弱于槲皮素, 但是普遍对人胃癌细胞MGC-803表现出较好的抑制作用(表3)。其中化合物3f的IC50可以达到8.24 μ g· mL-1。化合物3b对人前列腺癌细胞PC-3的抑制效果最好, IC50达到6.94 μ g· mL-1, 明显优于母核槲皮素。槲皮素3位以大于7个碳原子长度的脂肪酸取代, 有助于提高对人胃癌细胞MGC-803的抑制作用。
以廉价的芦丁为原料, 利用Williamson反应保护槲皮素7, 3', 4'位羟基, 经酸水解、Steglich酯化、催化加氢脱苄基, 合成了7个槲皮素酯类衍生物, 所有化合物均经过红外、核磁、质谱确证。与现有的其他路线相比较, 该路线具有选择性高、反应条件温和、操作简单、适于规模化生产的优点。初步构效关系研究发现, 槲皮素3位以4个碳以下的短链脂肪酸取代有利于增强其抗氧化活性, 而以长链脂肪酸取代有利于改善其抗肿瘤活性。采用MTT法评价了槲皮素及其7种衍生物对4种癌细胞的增殖抑制作用, 结果表明, 3e和3f对人胃癌细胞MGC-803的IC50值分别达9.35和8.24 μ g· mL-1, 远小于槲皮素, 有望进一步研究成为抗胃癌的候选药物。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|