作者简介:魏亚娟(1994—),女,内蒙古赤峰人,硕士研究生,研究方向为荒漠化防治,E-mail:2404336139@qq.com。
为探讨GGR6在榆叶梅壮苗培育中的应用,以1 a生榆叶梅幼苗为试材,采用盆栽试验,研究了不同浓度(0、50、100、150、200 mg·L-1)GGR6溶液对榆叶梅叶绿素含量、叶绿素荧光指标和生长指标的影响。结果表明,GGR6溶液能够有效促进榆叶梅幼苗株高和基径的增加,并使叶绿素含量和叶绿素荧光参数ETR、ΦPSⅡ、qP、 Fv/ Fm明显增加,qN显著降低。与对照相比,100 mg·L-1 GGR6处理使榆叶梅幼苗株高增加66.0%,基径增加51.6%,叶绿素a含量增加47.1%,叶绿素总量增加33.9%,ETR增加78.5%,ΦPSⅡ增加330.0%,qP增加198.9%,qN降低46.0%, Fv/ Fm、叶绿素b含量增加不明显。在榆叶梅壮苗培育中,100 mg·L-1 GGR6处理效果最好。
榆叶梅(Prunus triloba), 又名小桃红, 为落叶灌木或小乔木, 属蔷薇科桃属。其为温带树种, 耐寒、耐旱、不耐涝, 喜光, 对土壤的要求不严; 原产我国江苏、河北、山东、山西及浙江等地, 是我国北方地区园林、庭院中常见的一种观赏树种。国内学者对榆叶梅的研究较少, 大多集中在榆叶梅的整形修剪技术[1]、繁殖技术[2, 3, 4]、滞尘能力[5, 6, 7, 8]、水分利用效率[9]、抗寒性[10, 11]等方面。而植物生长调节剂对榆叶梅生长特性、叶绿素含量、叶绿素荧光特性方面的影响鲜有报道。
GGR6是一种生根粉, 具有加速植物新陈代谢、提高酶活性和促进细胞分裂的作用, 可显著提高作物产量和抗逆能力。为探索GGR6对榆叶梅生长的影响, 以1 a生榆叶梅幼苗为研究对象, 用不同浓度GGR6溶液对榆叶梅幼苗进行蘸根处理, 测定榆叶梅叶片的叶绿素含量、叶绿素荧光参数和生长指标, 寻找较为适宜的GGR6处理浓度, 为榆叶梅的栽培壮苗技术提供科学指导和理论依据。
试验在内蒙古乌审旗无定河镇国营纳林河林场的简易温室大棚内进行。该地区属于温带大陆性季风气候, 全年降水稀少, 降雨大多集中于7— 9月, 占全年降雨量的71%。该区域日照充足, 最高气温出现在7月, 为22 ℃, 最低气温出现在1月, 为-9.5 ℃。年平均温度为8 ℃。
为保证实验条件一致, 试验土壤为采自当地的风沙土。1 a生榆叶梅幼苗购买于当地林场, GGR6由北京艾比蒂生物科技有限公司提供。
2014年春季, 选取长势良好、均一的榆叶梅幼苗分别栽植于高26 cm、上口径24 cm、地径18 cm的花盆内, 每个花盆移栽1株, 进行正常的水肥管理。试验共设置5个浓度梯度, 分别为0、50、100、150、200 mg· L-1, 分别用CK、G50、G100、G150、G200表示, CK作为空白对照。每个梯度设置10个重复, 共50株。5月初进行灌根处理, 每个处理使用药剂量为300 mL。7月上旬, 每个处理随机选取5株, 进行叶绿素荧光参数测定。
叶绿素含量测定。采用80%丙酮浸提法提取榆叶梅叶片的叶绿素, 利用紫外线分光光度计测定叶绿素含量(mg· g-1)。
叶绿素荧光指标的测定。于天气晴朗的上午8:00— 11:00, 利用PMA 2500叶绿素荧光仪测定榆叶梅幼苗叶绿素荧光参数, 包括电子传递效率(photosynthetic electron transport rate, ETR)、光化学猝灭(photochemical quenching, qP)、实际光化学量子效率(actual photochemical efficiency of PSⅡ in the light, Φ PSⅡ )、非光化学猝灭(non-photochemical quenching, qN)。最大光化学效率(optimal/maximal photochemical efficiency of PSⅡ in the dark, Fv/Fm)
Φ PSⅡ =(F'm-Fs)/F'm。
式中:F'm(steady maximal fluorescence)为稳态的最大荧光; Fs(steady fluorescence)为稳态荧光。
Fv/Fm=(Fm-F0)/Fm。
式中:Fv(variable fluorescence)为可变荧光; F0(minimal fluorescence)为固定荧光; Fm(maximal fluorescence)为最大荧光产量。
生长指标的测定。于7月上旬, 利用直尺、游标卡尺分别测量长势均匀的榆叶梅幼苗株高、基径。每个处理各测定3株, 取平均值。
利用Microsoft Excel 2007分析试验数据, 采用SPSS 20.0的单因素分析法(one-way ANOVA)比较不同处理组间的差异, 并应用相关分析法和隶属函数对数据进行择优分析。
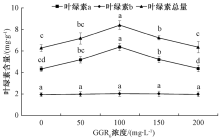
植物中的叶绿素含量是衡量植物叶片光合作用的重要指标, 与植物生长状况密切相关[12]。从图1可以看出, 随着GGR6浓度的增大, 榆叶梅叶片中叶绿素a、叶绿素总量均呈现先增大后减小的趋势, 且均高于对照组, 而叶绿素b几乎没有变化。当GGR6浓度达到100 mg· L-1时, 叶绿素a和叶绿素总量均显著高于其他处理, 叶绿素a、叶绿素b、叶绿素总量均达到最大值, 分别为6.36、2.03、8.39 mg· g-1, 比对照组分别增加了47.1%、4.4%、33.9%。对照组与各处理组的叶绿素b含量差异不显著。说明GGR6能够提高榆叶梅叶片的叶绿素a含量, 且在浓度达到100 mg· L-1时叶绿素含量最高。
2.2.1 叶片ETR、Φ PSⅡ
从图2可以看出, 随着GGR6浓度的增大, ETR、Φ PSⅡ 呈现先增大后减小的趋势。ETR的变化趋势较为平缓, Φ PSⅡ 的波动范围较大。当GGR6浓度达到100 mg· L-1时, ETR、Φ PSⅡ 均达到最大值, 分别为86.3、0.71, 分别比对照组增加了78.5%、330.0%(P< 0.05), 表明GGR6能显著促进榆叶梅叶片的光合电子传递速率。
2.2.2 叶片qP、qN
由图3可知, 随着GGR6浓度的增大, qP呈现先增大后减小的趋势。各处理组的qP显著高于对照组; 当GGR6浓度达到100 mg· L-1时, qP最大, 达0.85; G100与G150组qP差异不显著。qN的变化趋势与qP的变化趋势基本相反, 随着GGR6浓度的增大, qN呈现先减小后增大的趋势。对照组与G50、G200组差异不显著, 与G100、G150差异显著。对照组qN最高, 达0.83; 当GGR6浓度达到100 mg· L-1时, qN达到最低值, 为0.45。
2.2.3 Fv/Fm
从图4可以看出, 随着GGR6浓度的增大, Fv/Fm呈现先增大后减小的趋势。当GGR6浓度达到100 mg· L-1时, Fv/Fm最大, 显著高于其他组; 其他各组间差异不显著。说明GGR6对榆叶梅叶片Fv/Fm的促进作用不明显。
2.3.1 株高
幼苗株高是植物生长状况的直观表现, 在判定植物生长状况的过程中, 株高是一项重要的评价指标。从图5可以看出, 随着GGR6浓度的增大, 榆叶梅株高呈现先增大后减小的趋势。当GGR6浓度达到100 mg· L-1时, 植株最高, 显著高于其他组; 其他各组间差异不显著。说明GGR6对榆叶梅株高有促进作用, GGR6浓度为100 mg· L-1时, 对榆叶梅株高促进作用最明显。
2.3.2 基径
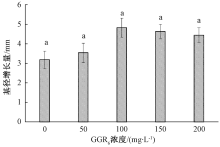
从图6可以看出, 榆叶梅基径增长量的变化趋势与株高的变化趋势一致, 随着GGR6浓度的增大, 榆叶梅的基径增长量呈现先增大后减小的趋势, 其趋势线变化比较平缓, 各组间差异不显著。当GGR6浓度达到100 mg· L-1时, 基径增长量最大, 为4.82 mm。
从表1可以看出, 叶绿素a和叶绿素总量分别与ETR、Φ PSⅡ 、qP、Fv/Fm、株高存在极显著正相关关系, 与qN存在极显著负相关关系, 与叶绿素b、基径的相关性不显著。说明叶绿素为榆叶梅幼苗进行光合作用奠定了物质基础, 光合作用为榆叶梅幼苗生长提供了物质来源。
| 表1 榆叶梅幼苗测定指标的相关性 |
相关性分析发现, 基径增长量和叶绿素b与其他各指标几乎不存在相关性, 从而筛选出叶绿素a、叶绿素总量、ETR、Φ PSⅡ 、qP、qN、Fv/Fm、株高共8个指标。通过这8个指标在不同浓度GGR6下的综合影响, 筛选出榆叶梅生长发育的最适GGR6浓度。具体评价方法是:将各指标的隶属函数值求和后, 再求平均值, 对最终的均值进行排序, 序号越小, 说明所对应的GGR6处理越好, 反之亦然。各指标隶属函数值按以下公式计算。
若指标与浓度呈正相关, 则X(U)=(X-Xmin)/(Xmax-Xmin);
若指标与浓度呈负相关, 则X(U)=1-(X-Xmin)/(Xmax-Xmin)。
式中:X为指标的平均值; Xmax和Xmin分别指测定值的最大值和最小值。
根据隶属函数分析得出:G100> G150> G200> G50> CK(表2)。表明100 mg· L-1 GGR6对榆叶梅生长的促进作用最明显, 其他浓度对榆叶梅生长的促进作用稍弱。
| 表2 不同浓度GGR6处理下榆叶梅幼苗各指标综合评定结果 |
GGR6作为一种新型的植物生长调节剂, 可以促进植物新陈代谢、植物根系生长和根系活力[13], 提高植物成活率和植物可溶性含糖量[14], 广泛应用于农作物、花卉、蔬菜等生产。合理使用GGR6有助于提高植物的光合作用, 达到壮苗的效果, 有利于植物更好地适应恶劣环境。榆叶梅叶绿素含量、叶绿素荧光参数和生长指标的相关性分析和隶属函数分析结果表明, GGR6浓度为100 mg· L-1时, 对榆叶梅的壮苗效果最好。
榆叶梅叶绿素含量的高低直接影响其光合作用能力[15]。GGR6溶液有利于提高榆叶梅叶片的叶绿素含量, 使其叶片颜色进一步加深。本研究结果表明, 叶绿素a和叶绿素总量与叶绿素荧光参数呈现极显著相关关系, 叶绿素b与叶绿素荧光参数的相关性不显著。这与李源等[16]对太阳扇叶片研究的结果不同, 其原因有待于进一步研究。不同浓度GGR6处理后, 榆叶梅叶绿素a、叶绿素总量均显著高于对照组。GGR6浓度为100 mg· L-1时, 处理效果最佳。GGR6对榆叶梅幼苗进行灌根处理, 可增进榆叶梅幼苗叶片的叶绿素含量, 有利于榆叶梅幼苗进行光合作用, 可以获得更高的光合效率, 积累更多的有机物质, 从而增强了榆叶梅幼苗的光合同化能力。
叶绿素荧光参数已经成为植物光合作用与环境关系的内在探针, 植物叶绿素荧光参数可反映植物光合作用的强弱[17]。本研究表明, 榆叶梅叶绿素荧光参数之间存在相关性, 各参数之间相互影响, 这与高天鹏等[18]对马铃薯的研究结果相似。适宜浓度(50、100 mg· L-1)GGR6溶液灌根处理使榆叶梅叶片叶绿素荧光参数显著提高, 100 mg· L-1的GGR6处理效果最佳, ETR、 Φ PSⅡ 、qP、Fv/Fm分别较对照组提高了78.5%、330.0%、198.9%和5.0%, qN较对照组降低了46.0%。这说明100 mg· L-1 GGR6处理榆叶梅幼苗, 其叶片PSⅡ 反应中心的开放程度最大, 有利于增强叶片实际光化学效率, 加快光合产物产生的速度, 激发榆叶梅光合活性, 叶片耗散的光能最少, 使更多的光能参与榆叶梅的光合作用, 增加榆叶梅的光能利用率。这与曹刚等[19]对黄瓜的研究结果相似。
榆叶梅幼苗株高和基径的增加进一步验证了GGR6溶液能够促进榆叶梅幼苗的生长。榆叶梅叶绿素含量与株高呈正相关, 与基径的相关性不显著。可能原因是GGR6可以诱导榆叶梅内源激素的合成, 促进细胞分裂素的合成, 进而促进榆叶梅细胞的分裂, 使基径增粗, 该结果与张金荣等[20]对华北落叶松的研究结果相似。100 mg· L-1 GGR6溶液对株高和基径的促进效果最佳, 株高和基径较对照组分别增加了66.0%和51.6%。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|