作者简介:赵芳娥(1990—),女,甘肃天水人,硕士,研究方向为家禽传染病,E-mail:1356178675@qq.com。
鸭传染性浆膜炎是一种感染多种禽类的接触性传染病,可引起免疫器官的损伤。本试验通过人工感染鸭疫里默氏杆菌,旨在探究病鸭免疫器官中Toll样受体2(toll-like receptors 2,TLR2)、Toll样受体4(toll-like receptors 4,TLR4)的分布与表达特征,借以评价鸭疫里默氏杆菌的致病作用。结果显示,攻毒后雏鸭脾脏红髓充血、出血,白髓萎缩、淋巴细胞稀散,脾小体淋巴细胞变性、坏死;法氏囊黏膜上皮脱落,腔上囊小结空泡化。攻毒后,TLR4表达量显著上升。脾脏红髓淋巴细胞胞质中TLR4呈阳性表达,白髓中央动脉周围分布大量阳性反应。法氏囊淋巴小结中分布大量Toll样受体4。与对照组相比,攻毒组TNF-α、IL-2、IL-6显著性上升,而IL-10基本不变。以上结果提示,鸭疫里默氏杆菌感染可提高免疫器官中Toll样受体4的表达、引起机体细胞因子表达发生变化,从而引起免疫器官的损伤。
鸭传染性浆膜炎(Riemerella anatipestifer, RA)又称鸭疫里默氏杆菌病, 是一种侵害鸭、鹅、火鸡等多种禽类的细菌性疾病[1, 2], 主要感染2~7周龄雏鸭, 常与其他细菌混合感染, 严重影响养鸭业的发展, 造成巨大的经济损失[3]。目前, 疫苗免疫是预防和控制鸭传染性浆膜炎的有效措施, 但鸭疫里默氏杆菌血清型复杂, 不同血清型之间交叉保护较低或缺乏, 导致疫苗免疫失效。
机体的天然免疫系统是防御病原体入侵的第一道防线, 动物机体表达不同的模式识别受体(pattern recognition receptor, PRRs), 识别病原体相关分子, 从而引发、活化抗病毒基因的表达, 实现宿主抵抗病原体的防御功能[4]。禽类PRRs已经被鉴定, 其中Toll样受体是禽类先天免疫系统中的关键组分, 在禽类传染病的预防、控制方面极其重要[5]。Toll样受体作为病原体相关分子模式(pathogen-associated molecular patterns, PAMP)的感受器, 是介导宿主对各种病原体识别、产生免疫和炎症反应的关键分子, 激活时不仅会诱导天然免疫应答, 同时还能激活获得性免疫系统。在机体抵抗病原体研究方面, Toll样受体2(toll-like receptors 2, TLR2)、Toll样受体4(toll-like receptors 4, TLR4)是最为重要的2类受体。TLR2可特异性识别细菌表面的脂蛋白。TLR4能够特异性识别革兰氏阴性菌的脂多糖(lipopolysaccharide, LPS)[6, 7], 特异性识别LPS后, 其胞外部分与LPS结合形成复合物, 形成的Toll样受体— LPS复合物引起胞内Toll样受体C端TIR区招募胞浆内的接头蛋白, 然后通过一系列酶生化反应, 促进核转录因子κ B(transcription factor κ B, NF-κ B)的核转位, NF-κ B进入到细胞核内可对多种炎症因子基因及免疫相关基因进行表达调控[8, 9], 激活天然免疫[10]。参与获得性免疫应答的辅助性T细胞1/2可被细胞因子和共刺激分子激活后增殖、分化, 进一步会启动机体的获得性免疫系统[11, 12]。
本研究将25日龄雏鸭人工染病, 在感染24 h后采集免疫器官组织样品, 运用免疫组化和免疫印迹方法测定组织中Toll样受体的分布与表达, qRT-PCR检测部分细胞因子mRNA丰度的变化, 旨在探索雏鸭天然免疫系统抵抗鸭疫里默氏杆菌感染的机理, 为研究新型高效疫苗提供理论参考。
鸭疫里默氏杆菌血清1型SG4株由中国农业大学提供, 25日龄雏鸭(绍兴麻鸭)由绍兴某种鸭场提供。
4%多聚甲醛、兔抗-Toll样受体2多克隆抗体(BS7380)、兔抗-Toll样受体4多克隆抗体(BS3489)、HRP标记的羊抗兔IgG等购自巴傲德生物科技有限公司; SABC试剂盒、DAB显色液、BCA蛋白检测试剂盒、ECL化学发光检测试剂盒等购自武汉博士德生物科技有限公司。
1.2.1 处理设计
随机选取鸭传染性浆膜炎血清抗体阴性的雏鸭21羽, 攻毒组5羽, 对照组2羽, 每个处理设3个重复。攻毒组每羽雏鸭腿部肌肉注射1.0× 1010 CFU的鸭疫里默氏杆菌SG4株菌液, 攻毒后观察雏鸭发病和死亡情况。
1.2.2 样品采集
将攻毒组病变明显的雏鸭和对照组雏鸭颈动脉放血处死, 摘取脾脏和法氏囊, 固定于4%多聚甲醛溶液中备用。
1.2.3 组织学观察
取脾脏和法氏囊, 制作5 μ m厚度石蜡切片, HE染色并在显微镜下观察。石蜡切片脱蜡至水, 进行免疫组化染色, 制片并在显微镜下观察, 检测TLR2、TLR4在鸭脾脏、法氏囊中的分布。
1.2.4 细胞因子检测
用Trizol提取脾脏、法氏囊组织总RNA, 反转录成cDNA作为PCR模板, 根据GenBank检索的TNF-α 、IL-2、IL-6、IL-10、β -actin基因编码序列设计引物(表1), 使用荧光定量试剂盒进行Real-time PCR。以β -actin基因为内参, 2-△ △ Ct定量细胞因子。
| 表1 基因编码序列设计引物的信息 |
1.2.5 Western blot检测鸭脾脏、法氏囊中TLR2、TLR4的表达
使用RIPA蛋白裂解液提取总蛋白, 并用BCA蛋白含量检测试剂盒检测蛋白浓度, 将各组蛋白浓度调至一致, 加入蛋白上样缓冲液, 煮沸10 min后保存。取10 μ L蛋白样品进行Western blot试验, 将TLR2、TLR4抗体1:1 000稀释, 以β -actin为内参, 检测TLR2、TLR4蛋白的表达情况。
采用GraphPad Prism软件作图, SPSS统计分析, 单因素方差分析比较结果, P< 0.05表示差异显著, P< 0.01差异极显著, 结果以平均值± 标准误表示。
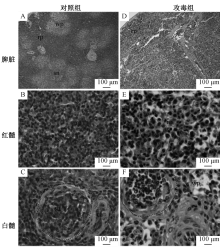
脾脏组织病理学变化见图1。与对照组相比, 攻毒组雏鸭脾脏肿大, 表面有纤维素膜, 呈现出大理石状。脾脏红髓充血、出血, 窦显著扩张、淋巴细胞排列散乱。脾脏白髓萎缩, 淋巴细胞稀散, 中央动脉内皮细胞显著肿胀, 脾小体中淋巴细胞变性、坏死, 细胞散乱, 细胞间隙增加, 组织结构疏松。
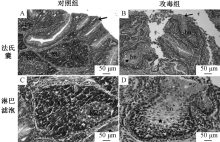
法氏囊的组织病理学变化见图2。攻毒组雏鸭法氏囊黏膜上皮严重破损, 上皮微绒毛断裂、脱落于管腔; 淋巴滤泡皮质变薄, 淋巴细胞减少, 髓质细胞严重变性、坏死、溶解, 滤泡中心出现大小不一的空泡, 网状细胞增多。许多淋巴细胞胞质、胞核浓缩, 出现细胞退行性变化。
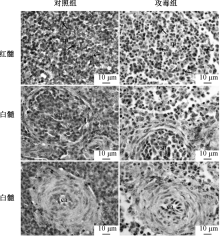
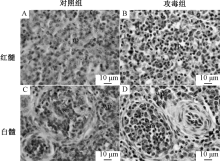
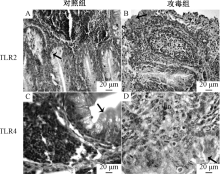
TLR2、TLR4在鸭脾脏中分布见图3~4。TLR4在鸭脾脏红髓和白髓都有分布, 且白髓主要分布于中央动脉周围。当鸭感染传染性浆膜炎后, 与对照组相比较, TLR4分布于整个细胞质, 白髓脾小体中出现TLR4, 中央动脉周围TLR4分布显著增多。
如图5所示, TLR2、TLR4主要分布于法氏囊的黏膜上皮和腔上囊小结。攻毒后, 空泡化的腔上囊小结中分布大量的TLR4。
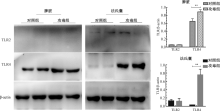
如图6所示, TLR2在鸭脾脏中不表达。法氏囊中, 各组TLR2表达量无显著差异。TLR4在鸭脾脏中表达, 攻毒后表达量显著高于对照组; 而在正常法氏囊中TLR4的表达量很低, 但攻毒后极显著的增加。
鸭传染性浆膜炎是我国养鸭场常发、难以防治、造成养鸭业经济损失较为严重的传染病之一。多年来, 国内外学者对鸭传染性浆膜炎的流行病学、血清学分型、临床诊断及防治等进行了较深入的研究[13, 14, 15]。然而, 在疫苗免疫过程中, 由于鸭疫里式杆菌血清型复杂, 且不同血清型之间交叉保护缺乏, 常导致免疫失败[16]。当细菌、病毒等病原体感染动物机体时, 先天性免疫是机体抵御入侵病原微生物的第一道防线。宿主细胞通过特定模式识别受体, 识别不同类型的病原微生物, 继而激活一系列级联信号通路, 建立宿主的天然免疫反应[17]。模式识别受体中, Toll样受体是比较重要的一种, 禽类与哺乳动物这2类脊椎动物的Toll样受体可识别相似的微生物产物。目前, 在禽类疾病中相关的研究还很少[18, 19]。本试验对25日龄鸭人工感染传染性浆膜炎强毒SG4株后, 对鸭免疫器官脾脏和法氏囊的TLR2、TLR4的表达与分布定位进行研究。已有研究发现, LPS诱导炎症可导致TLR4表达显著增加[20]。当动物机体通过Toll样受体识别病原微生物后, 最终可通过多条信号通路诱导大量炎症因子的表达, 进而形成一系列炎症反应[21]。本研究证明, 鸭疫里默氏杆菌可诱导雏鸭免疫器官中TLR4表达显著增高, 攻毒组雏鸭免疫器官中主要是通过激活TLR4的内吞作用继而诱导TNF-α 、IL-2、IL-6等炎症因子的表达, 继而激活宿主天然免疫系统。以上结果提示, TLR4介导的信号通路在雏鸭抵抗病原菌感染中发挥重要作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|