作者简介:姜兴粲(1994—),男,山东牡丹区人,硕士,研究方向为兽医药理学与毒理学,E-mail: Jiangxingcan0908@163.com。
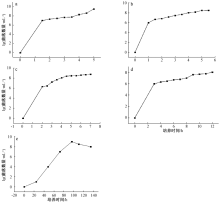
为测定《中国兽药典》(2015版)中5种标准菌的生长曲线,并对其方法的合理性进行讨论,参照《微生物学实验》(第4版)中细菌生长曲线的制作方法,以《中国兽药典》(2015版)规定的5种标准菌株大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌、黑曲霉为研究对象,进行了菌株生长曲线的测定。结果表明:大肠埃希菌在1.5~4.5 h处于稳定期,金黄色葡萄球菌在1.0~5.5 h处于稳定期,铜绿假单胞菌在2.0~7.0 h处于稳定期,白色念珠菌在3.0~12.0 h处于稳定期,黑曲霉菌在96.0~110.0 h处于稳定期。多种标准菌株稳定期的测定完成,对相关微生物实验的进行具有重要的参考意义。
细菌的生长曲线反映了细菌在培养过程中生长、繁殖和衰亡的规律, 在适宜条件下培养, 会出现延迟期、对数生长期、稳定期和衰退期4个阶段。本文采用光电比浊法和活菌计数法测定菌株的生长曲线, 了解其生长特性与差异。一般情况下, 微生物实验操作步骤繁多, 实验条件严苛, 本研究在实验过程中发现了一些问题, 获得了丰富的经验并总结了若干条注意事项, 期望为以后的研究工作提供参考。
1.1.1 菌种
大肠埃希菌(Escherichia coli)[CMCC(B)44102]、金黄色葡萄球菌(Bacillus)[CMCC(B)26003]、铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]、白色念珠菌(Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillus niger)[CMCC(F)98003]菌种均来自中国食品药品检定研究院。
1.1.2 仪器及试剂
SW-CJ-2FD型双人单面净化工作台、隔水式恒温培养箱(上海一恒科学仪器有限公司)、恒温振荡器、数控超声波清洗器、电热恒温鼓风干燥箱、LDZM-60KCS-Ⅱ 立式压力蒸汽灭菌器、优普超纯水制造系统、细菌/细胞密度计、比色杯(光径为10 mm)、sartoriusBSA423S-CW天平、烧杯、试管、三角瓶等。胰酪大豆胨琼脂培养基(产品批号1073191)、胰酪大豆胨液体培养基(产品批号1073051)、沙氏葡萄糖琼脂培养基(产品批号1072401)、沙氏葡萄糖液体培养基(产品批号1073051)均购自广东环凯微生物科技有限公司; 0.9%无菌氯化钠溶液(产品批号L2018041910)。
1.2.1 菌种培养与活化
参照《中国兽药典》(2015年版)的方法进行。把标准菌株大肠埃希菌CMCC(B)44102, 金黄色葡萄球菌CMCC(B)26003, 铜绿假单胞菌CMCC(B)10104接种在胰酪大豆胨液体培养基中, 35 ℃ 220 r· min-1振荡培养。白色念珠菌CMCC(F)98001接种在沙氏葡萄糖液体培养基中, 25 ℃ 220 r· min-1振荡培养。传代培养至第2代, 把菌株培养到第3代后即复苏完成。在培养第3代菌株时, 先把第2代菌株的菌悬液稀释后接种到固体平皿培养基上, 以便于挑取单个菌落。黑曲霉CMCC(F)98003为产孢子繁殖的真菌, 在沙氏葡萄糖琼脂斜面培养基中培养至第3代, 即完成活化[1, 2, 3]。
1.2.2 光电比浊法
分别挑取大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌的单个菌落接种于胰酪大豆胨液体培养基中, 挑取白色念珠菌的单个菌落接种于沙氏葡萄糖液体培养基中。按1.2.1节的条件培养以上菌种, 在不同的时间点测定菌悬液在600 nm的吸光度D600, 同时用0.9% NaCl稀释菌悬液至适当的浓度后, 按《中国兽药典》(2015年版)附录1105平皿法计数并记录数据。
黑曲霉菌产生丰富的孢子后, 由于孢子呈黑色, 吸光度过大, 首先进行预实验。查阅资料后, 在预实验中选取D600为1.0时的菌悬液进行实验并记录数据[1, 2, 4]。
微生物计数仪误差较大且应用光电比浊计数法时应格外注意比色器皿的透光度, 平皿计数时统计3个平皿, 取平均值。
1.2.3 标准曲线绘制
分别以时间为横坐标, 菌落形成数量对数值为纵坐标绘制大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌、黑曲霉菌和白色念珠菌的生长曲线[2, 3, 4, 5, 6, 7, 8]。
大肠埃希菌在接种后至1.5 h处于对数生长期, 在1.5~4.5 h处于稳定期, 在此期间菌落的数量级为108 mL-1(图1中a)。金黄色葡萄球菌在接种后至1.0 h左右时处于对数生长期, 在1.0~5.5 h处于稳定期, 在此期间菌落的数量级为107 mL-1, 随后细菌生长状态进入衰退期(图1中b)。铜绿假单胞菌在接种后至2.0 h处于对数生长期, 在2.0~7.0 h处于稳定期, 在此期间菌落的数量级为108 mL-1(图1中c)。白色念珠菌在接种后至3.0 h处于对数生长期, 在3.0~12.0 h处于稳定期, 在此期间菌落的数量级为107 mL-1(图1中d)。黑曲霉在接种后至24.0 h处于延迟期, 在24.0~96.0 h处于对数生长期, 在96.0~110.0 h处于稳定期, 在此期间菌落的数量级为108 mL-1, 随后黑曲霉孢子生长状态进入衰退期(图1中e)。
综上可知, 标准菌株大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌在《中国兽药典》(2015年版)规定的培养条件下进行培养测定时, 4种菌株的生长趋势相近, 金黄色葡萄球菌的生长速率最快, 白色念珠菌的生长速率最慢。从趋势上来看, 细菌的生长速率高于真菌的生长速率。实验中, 对黑曲霉菌的预实验结果进行了二次验证, 2次的结果十分相近, 即D600为1.0时, 数量级均为107 mL-1, 符合《中国兽药典》(2015年版)供试品中接种量的要求, 故在完成预实验后即可开始正式实验。此次实验中采用加大接种量的方式, 来减少实验过程中所需要的时间。对产生孢子或有色物质的微生物采用平板菌落计数法测定生长曲线, 例如对黑曲霉菌的测定。一般的菌种生长曲线为“ S” 型, 生长初期与后期的菌株活力较弱, 实验中选择处于对数期即以指数倍增期的“ 种苗菌” 为传代菌源, 所以接种开始其生长曲线即为对数生长期, 没有延迟期。
参照《中国兽药典》(2015年版)的方法, 对大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌、黑曲霉5个标准菌种进行了生长曲线的测定。实验结果表明, 大肠埃希菌在1.5~4.5 h处于稳定期, 金黄色葡萄球菌在1.0~5.5 h处于稳定期, 铜绿假单胞菌在2.0~7.0 h处于稳定期, 白色念珠菌在3.0~12.0 h处于稳定期, 黑曲霉菌在96.0~110.0 h处于稳定期。多种标准菌株稳定期的测定完成, 对相关微生物实验的进行具有重要的参考意义, 对食品工业、生物工程、卫生医药和环境保护等多个领域具有参考和利用价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|