作者简介:魏建芬(1984—),女,山东青岛人,工程师,硕士,从事园林植物栽培技术工作,E-mail:wss12608@163.com。
以杭州黄、日香桂和硬叶丹桂3个桂花品种为试验材料,研究NaCl胁迫对其幼苗生长、光合作用、蒸腾速率及根系和叶片中Na+和K+分配的影响,以期筛选出较耐盐碱的桂花品种。研究发现,随着盐胁迫的增加,3个桂花品种新梢萌发和高生长受到明显抑制,光合作用和蒸腾速率显著降低,根系和叶片内Na+和Na+/K+增加,而K+总体降低。经生长和生理指标综合比较发现,在低盐浓度下,可选杭州黄作为绿化苗木;在中高盐浓度下,日香桂的耐盐性强于其他两个品种,而硬叶丹桂的耐盐性最弱。
盐碱土是地球陆地上分布广泛的一种土壤类型, 约占陆地总面积的25%。在我国盐碱土的总面积约有0.333亿hm2, 其中已开垦的有0.133亿hm2, 还有近2 000万hm2的盐碱荒地有待利用改良, 而滨海地区人口密集, 经济发展迅速, 生态环境问题日益突显, 其土壤盐渍化问题亟需解决。近年来随着滨海地区的发展, 滨海工业园区、滨海住宅区以及滨海旅游等产业的逐渐兴起, 人们越来越重视滨海地带植物景观的营造工作[1]。但由于乡土耐盐植物种类单一, 并不能达到预期的景观效果, 因此, 对景观价值高的非耐盐植物进行抗盐性研究, 从而筛选合适的植物种类。
土壤盐渍化后会对植物生长、渗透调节、光合作用、蒸腾作用等产生一系列的影响[2, 3, 4]。在生长方面, 随着盐浓度增加, 植物高生长受到抑制, 叶片发黄, 叶面积减少, 开花减少, 成熟加快[5, 6]。在光合和蒸腾方面, 随着盐胁迫增加, 叶绿素含量下降, 与光合有关的酶受到抑制, 植物的净光合速率降低[7, 8]; 盐胁迫的增加也会引起土壤水势降低, 植物水分吸收困难, 导致蒸腾作用下降[9]。植物为了生存就需要保持同土壤环境的一种平衡态, 因此当盐增加土壤水势降低时, 植物也必须吸收和合成一定量的矿质元素和可溶性有机物质[2, 10]。有研究表明, 盐胁迫后植物体内Na+, K+, Cl-, Mg2+含量升高, 脯氨酸和可溶性糖含量升高[2]; 也有研究表明, 随植物体内Na+和Cl-的增加, 吸收位点的竞争会导致K+和Ca2+的亏缺[11, 12]。因此, 不同植物也可能有不同的抗盐性和抗盐方式。
桂花(Osmantus fragrans Lour.)原产我国, 为木犀科木犀属园林观赏植物, 分为四季桂、银桂、金桂、丹桂4个品种群。1987年桂花被选入中国传统十大名花, 其特点是树姿优美, 碧叶如云, 四季常绿, 芳香馥郁, 是我国园林绿化中应用最广和最受欢迎的优良绿化观赏和香花树种之一。目前对于桂花耐盐碱方面的研究报道较少。为此, 本文以3年生桂花扦插苗为研究材料, 比较杭州黄、日香桂和硬叶丹桂3个桂花品种在不同浓度NaCl胁迫下的生长变化和生理反应, 旨在了解其耐盐力的强弱, 为桂花抗盐品种的选育和在滨海绿化中的推广应用提供技术参考。
选择杭州黄(O. fragrans Hangzhou Huang)、日香桂(O. fragrans Rixianggui)和硬叶丹桂(O. fragrans Yingye Dangui)3个优良桂花品种作为试验材料。其中, 杭州黄为金桂, 日香桂为四季桂, 硬叶丹桂为丹桂。试验苗均为长势健壮、无病虫害的3年生扦插苗, 平均苗高50~55 cm, 平均地径1.8~2.5 cm, 栽培基质V黄泥:V泥炭:V松鳞为2:4:4, 种植在上口径28 cm、下口径23 cm、高24 cm的3号加仑盆中, 每品种150株, 2016年9月进行盐处理。
将氯化钠分别配成浓度为0.3%、0.5%、0.7%的盐溶液, 用自来水作对照, 对不同品种的桂花幼苗进行基质浇灌处理。连续浇灌3 d后测定每处理的盐含量, 以此为准, 在后期试验过程中, 每隔3 d测定1次土壤盐分含量, 根据测定结果, 随时补浇对应浓度的盐水, 以保持每个处理盐浓度的一致性。每处理3组重复, 每组重复50株苗。
盐水处理后, 选取不同品种不同处理生长一致的10个枝条, 自新芽发出起每隔5 d测定新梢生长量, 直至停止生长, 计算其高生长量。在高浓度盐分处理出现不良反应初期, 测定幼苗光合和蒸腾速率。试验后期, 统计新抽梢量。
采集植株的根系和新生叶片样品, 放在65 ℃烘箱中烘至恒重, 用粉碎机磨碎, 过0.3 mm网筛, 用于化学分析。试验中土壤盐浓度测定参考土壤农业化学分析方法[13]进行, 植物根系和叶片中Na+和K+含量测定则是根据《林业标准汇编》(1991)[14]执行, 即用硫酸消煮植物根系和叶片样品, 用原子吸收法测定其Na+和K+含量。
用多重比较(Duncan’ s)分析同一桂花品种不同盐浓度处理下的生长量、光合速率和蒸腾速率, 以及根系和叶片中元素含量差异。数据处理采用SAS for windows V8, 绘图则采用Sigmaplot 10.0。
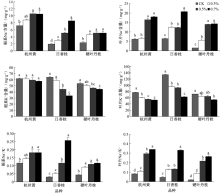
由图1可知, 盐胁迫显著影响不同品种桂花的抽梢数和高生长。杭州黄和日香桂对盐分比较敏感, 经盐处理后其抽梢数显著降低, 但不同盐浓度对抽梢数影响不显著; 硬叶丹桂在对照和低盐浓度下抽梢数不受影响, 但高浓度盐处理显著抑制其抽梢。盐胁迫对不同品种桂花高生长抑制作用显著。对杭州黄和日香桂而言, 盐分浓度越高, 抑制作用越明显; 而硬叶丹桂对盐分耐受性低, 不同浓度的盐胁迫均显著抑制其高生长。
盐胁迫会直接影响植物的水分利用效率, 间接影响植物的光合和蒸腾速率。由图2可知, 随着盐浓度增加, 3个桂花品种的光合速率均呈降低趋势。盐胁迫也显著抑制植物的蒸腾速率, 0.3%浓度盐处理下, 蒸腾速率即显著降低, 杭州黄、日香桂和硬叶丹桂分别降低52.1%、56.7%和44.7%; 但随着盐分浓度的增加, 3个桂花品种在0.5%和0.7%处理时并未表现出显著差异。
盐胁迫影响植物营养吸收和分配。由图3可知, 盐胁迫显著增加杭州黄和硬叶丹桂根系中Na+含量, 但不同处理间差异不显著, 日香桂中Na+含量则随着盐处理浓度的增加而增加。叶片和根系中的Na+出现不同程度的增加趋势。杭州黄叶片在0.3%盐浓度胁迫下, Na+含量与对照无显著差异, 但显著低于0.5%和0.7%盐浓度; 日香桂叶片在0.3%和0.5%盐浓度下, Na+含量无显著差异, 但显著高于对照, 显著低于0.7%盐浓度。研究发现, 盐胁迫对杭州黄根系中K+含量影响不显著, 并且低浓度的(3‰ )盐胁迫对日香桂和硬叶丹桂根系中K+含量影响也不显著, 但K+含量随盐浓度增加呈降低趋势。随着盐浓度增加, 杭州黄和日香桂叶片中K+含量表现出总体降低的趋势, 而硬叶丹桂在0.3%和0.5%盐胁迫下, K+含量与对照差异不显著, 但在0.7%盐胁迫下显著降低。根系和叶片中Na+/K+总体呈现出随盐浓度增加而增加的趋势。
盐胁迫影响植物生理代谢, 不同程度的影响植物生长。研究发现, 随着盐胁迫的增强, 3个桂花品种其抽梢量和高生长均受到明显抑制, 这与乌凤章等[5]对蓝莓和袁军伟等[10]对葡萄的研究结果相一致, 但不同桂花品种受抑制的程度不同。在0.3%浓度盐胁迫时, 杭州黄和日香桂的抽梢量就呈显著下降趋势, 且在盐分继续升高后对其抽梢量影响不大; 但对硬叶丹桂而言, 低盐浓度胁迫不会影响其抽梢数量, 只有当盐胁迫浓度达到0.7%时才显著降低。这表明杭州黄和日香桂的抽梢量对盐分胁迫更加敏感, 低浓度的盐胁迫既可影响其生长。但就3个桂花品种的高生长而言, 硬叶丹桂对盐分胁迫更加敏感, 在0.3%盐浓度时, 其高生长即被显著抑制, 而另两个品种受抑制的程度明显低于硬叶丹桂。本研究结果表明, 盐胁迫下不同桂花品种会出现不同的生长反应, 杭州黄和日香桂可能优先选择高生长, 而硬叶丹桂则选择更多的抽新梢。综合分析发现, 在低盐浓度(0.3%)胁迫时, 3个桂花品种生长差异不显著, 而在中高等浓度(0.5%)胁迫时, 日香桂长势要总体优于杭州黄, 硬叶丹桂长势最差, 即耐盐性最弱。
研究结果发现, 3个桂花品种苗的光合速率均随着盐分浓度的增强而降低, 并且不同处理间均存在着显著差异, 这与王臣等[7, 15]的研究结论相似。盐胁迫对植物光合作用的抑制效应主要有三方面的原因:一是盐胁迫使叶绿体结构发生变化; 二是影响叶片中叶绿素的含量; 三是影响与光合作用有关的酶活性[2]。但目前关于盐胁迫下植物光合作用下降的原因还没有形成统一认识, 而现有数据也不足以解释盐胁迫下光合作用下降的具体机制问题。但一般认为, 盐分胁迫对光合作用的影响是通过气孔因素和非气孔因素来实现的, 在低盐浓度时气孔因素可能占主导作用, 而在高盐浓度下非气孔因素可能起主要作用。杨秀莲等[16]也发现, 随着盐胁迫浓度的增加, 5个桂花品种叶片表面的气孔密度增加, 但张开的气孔密度却不断减少, 并且在盐胁迫下叶绿体、细胞核等会受到不同程度的损伤, 且浓度越高损伤则越大。若按上述评判结果分析, 3个桂花品种的光合速率在0.7%盐胁迫下的降幅是0.3%下的2倍, 因此, 0.3%盐浓度下的光合速率下降可能主要是由气孔关闭引起的, 而在0.7%甚至0.5%(0.5%是结合蒸腾速率发现的)盐浓度下, 光合速率下降可能已超出气孔控制范围, 主要由非气孔因素诸如叶绿体结构破坏和细胞核染色体降解等原因引起。
随着盐胁迫程度的加剧, 植物蒸腾速率降低, 这与苏兰茜等[8]对2种菠萝蜜属植物的研究结果一致。这可能主要是因为盐胁迫后, 土壤水势降低, 植物吸水困难, 而降低的植物蒸腾速率可减少水分散失, 从而尽可能的维持植物体内的水平衡。在0.3%盐分浓度下, 3个桂花品种蒸腾速率均出现显著的降低, 但随着盐胁迫的加剧(0.5%和0.7%处理), 植物蒸腾速率继续下降, 但并未出现显著差异。这表明0.5%的盐胁迫浓度可能是植物蒸腾速率的一个临界值, 当超过这个值时, 植物气孔的调节幅度也可能受到限制, 因此发挥的作用也并不显著, 这种变化趋势与光合速率相似。
盐胁迫下, 植物除易受到高浓度盐离子带来的渗透危害外, 还易受到盐离子浓度过高导致的离子毒害。Na+在盐生植物中可起到调节渗透压和影响水分平衡的作用, 然而累积过多的Na+会破坏离子平衡和使相关代谢酶失活。研究发现, 随着盐浓度的增加, 3个桂花品种根部和叶片中Na+含量增加, K+含量总体降低, Na+/K+值增加, 这与刘咏梅等[6]对3种柽柳属植物的研究结果基本一致。非盐生植物的耐盐性主要取决于是否植物根系能限制Na+的吸收和在叶片中维持低水平的Na+含量[17]。据此判断, 杭州黄可轻松适应0.3%盐浓度环境, 因为研究发现, 根系中Na+含量尽管升高但不明显, 而叶片中Na+变动不显著。杭州黄在0.5%盐浓度时, 根系Na+含量即与高浓度处理(0.7%)趋于一致; 而硬叶丹桂则在0.7%时, 与中高浓度盐处理趋于一致; 但日香桂根系中Na+含量则随着盐胁迫的增加而增加。这表明日香桂根系对高盐胁迫可能有更高的缓冲性。
同离子在不同的植物器官中其含量也不尽相同。叶片作为地上部分最活跃的组织, 其Na+和K+含量高于根系, 可能是由于叶肉细胞中有较大的液泡, 通过离子区域化作用, 可积累更多的离子, 从而起到渗透调节的作用, 有助于植物吸收水分[18]。杭州黄和日香桂在此方面表现明显。比较发现, 硬叶丹桂在叶片离子含量增加不明显, 也进一步印证了其弱的耐盐性。K+是植物体内仅次于N含量的重要矿质元素, 与渗透压调节、离子平衡、蛋白质合成和光合作用密切相关[19]。本研究发现, 盐处理可抑制植物体内K+的吸收, 并且随着胁迫程度的提高, 根系和叶片内K+含量越低。这可能是由于植物体内Na+和K+相互竞争转运体结合位点, 当Na+含量升高时, 积累Na+会抑制Na+/K+交换, 从而使根系中K+含量明显下降[15]。
盐胁迫显著影响3个桂花品种的生长和生理代谢。随着盐胁迫的增加, 植株生长受到抑制, 光合和蒸腾作用显著降低。此外, 盐胁迫也会影响到植物体内不同组织间的离子分配和平衡, 随盐浓度的增加, 根系和叶片内Na+和Na+/K+增加, 而K+总体降低。经综合对比发现, 不同桂花品种对盐胁迫有不同的适应性反应, 在低盐浓度下可选杭州黄作为绿化苗木, 在中高盐浓度下日香桂的耐盐性强于其他两个品种, 硬叶丹桂的耐盐性最弱。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|