作者简介:李丽莉(1994—),女,新疆昌吉人,硕士生,研究方向为西瓜分子育种,E-mail: 19906734996@163.com。
本研究在传统浸根法的基础上加以改良,对5 d苗龄的西瓜幼苗的胚根进行枯萎病接种,接种5 d左右即可鉴定出10份不同的西瓜种质材料枯萎病抗性。根据植株病情指数进行综合评价,并用DAB染色对其结果进行验证,共获得西瓜枯萎病2号生理小种高抗材料1份,中抗材料3份,低抗材料4份,感病材料2份。与常规西瓜接种鉴定相比,此接种鉴定方法简单,易操作,缩短了接种时间,发病快,节省时间和空间成本,大大提高了接种效率。
西瓜(Citrullus lanatus)为葫芦科西瓜属一年生藤本植物, 是重要的经济作物, 在我国的种植面积和产量均居世界第一位[1]。枯萎病是由尖孢镰刀杆菌(Fusarium oxyporum f.sp.niveum)引起的一种世界性土传病害[2], 病原菌可在土壤中存活多年并逐渐积累, 一般在连作地区发病较为严重。西瓜枯萎病发病率一般在20%~40%左右, 严重时高达80%, 甚至绝产[3, 4, 5]。西瓜枯萎病病原菌主要从根部侵入, 通过阻塞维管束和导管来影响植物的水分运输, 造成植株萎蔫; 同时分泌毒素, 干扰寄主代谢功能, 并且积累大量的酮类化合物, 使寄主导管处变为褐色甚至死亡[6]; 植株在整个生育期都会发病; 西瓜幼苗发病时顶端呈失水状, 子叶和叶片萎蔫下垂, 茎蔓基部失水皱缩, 严重时变为褐色并猝倒。目前防治西瓜枯萎病的方法有嫁接[7]、化学防治[8, 9]等措施, 其中利用抗病品种防治西瓜枯萎病是最为经济有效的措施[10]。
西瓜抗病性鉴定、筛选、评价工作是抗病育种的重要环节。建立客观的接种鉴定体系, 对筛选西瓜枯萎病抗病种质资源具有重要意义。西瓜枯萎病抗性鉴定及评价的常用方法有土壤接种法[11]、孢子悬浮液浸根接种法[12]、灌根接种法[13]、蘸胚根法[14]。其中, 土壤接种法发病率较轻且不均匀; 灌根法发病率低且不稳定; 蘸胚根法易操作但潜育期较长, 一般为8~9 d; 孢子悬浮液浸根接种法是目前西瓜枯萎病接种鉴定广泛采用的一种方法, 潜育期在4 d左右, 而且发病率较高, 在西瓜枯萎病材料的接种鉴定上取得显著成效, 但该法鉴定周期较长, 易受到植株生长状态及外部环境的影响, 影响对品种抗性的客观评价, 资源评价成本较高, 降低了抗性品种的选育效率。
本研究在传统的孢子悬浮液浸根法的基础上加以改良, 采用西瓜专化型尖孢镰刀杆菌生理小种2, 对露白5 d后的西瓜幼苗的胚根进行接种, 接种5 d后观察10份西瓜材料植株的生长状态, 并统计不同品种的发病率和病情指数, 根据病情指数对西瓜种质材料进行抗病性鉴定评价, 并利用DAB染色对该方法的鉴定结果进行验证。与常规的枯萎病接种体系相比, 此接种鉴定方法简单, 易操作, 缩短了接种时间, 且发病快, 节省时间和空间成本。
试验所用病原菌为西瓜专化型尖孢镰刀杆菌2号生理小种, 由本实验室保存。所用接种材料为浙江省农科院蔬菜所西瓜研究室搜集的10份西瓜种质材料, 分别为Ford hook、PI288317、PI368509、PI536457、冬瓜皮、PI278038、PI279460、Sun sweet、广二和庆久。分别将10份材料的种子去皮, 在10%NaClO中消毒15 min, 无菌水中润洗3次, 每次5 min, 用滤纸吸去多余水分, 将消毒后的种子置于透明塑料盒中, 在塑料盒底部放入两层滤纸, 并加入无菌水使其完全湿润, 倒掉多余水分, 置于温度为25 ℃、湿度为90%、光周期为16 h/8 h的光照培养箱中培养, 培养5 d, 待植株两片子叶完全展开转绿时, 准备进行枯萎病病菌的接种。
液体PDA培养基配制。取马铃薯葡萄糖肉汤25 g, 加入1 L蒸馏水, 搅拌至完全溶解, 校正pH为5.4。分装至500 mL三角瓶中, 每瓶200 mL, 置于121 ℃高压灭菌锅灭菌15 min, 冷却后备用。
固体PDA培养基配制。称取马铃薯葡萄糖琼脂46 g, 加入1 L蒸馏水, 加热搅拌至完全溶解, 校正pH为6.0。置于121 ℃高压灭菌锅灭菌15 min, 冷却至45 ℃左右倒平板备用。
尖孢镰刀杆菌培养。将-70 ℃冰箱保存的西瓜枯萎病2号生理小种转到PDA固体培养基活化, 菌丝生长较快, 初期白色, 随后菌丝变为玫红色, 培养至菌丝长满板时, 在超净工作台上将菌丝转移至200 mL PDA液体培养基中, 置温度28 ℃、转速200 r· min-1的摇床中培养12 h, 使其产生大量孢子, 将含孢子的PDA培养基用2层无菌纱布过滤, 除去多余的杂质, 利用血球计数板在显微镜下将孢子悬浮液的浓度调整到1* 107· mL-1, 用于接种鉴定。
将生长5 d的西瓜幼苗的胚根完全浸没在上述配置的枯萎病菌孢子悬浮液中, 5 min后取出, 用灭菌滤纸吸干根表多余菌液, 再用无菌水将根洗干净, 放回塑料盒中, 将塑料盒放回培养箱培养。5 d后调查发病情况。
病情严重度分为4级。0级, 植株未发病, 长势正常; 1级, 植株发病较轻, 少量须根颜色变为浅褐色; 2级, 叶片轻度萎蔫, 大部分须根颜色发褐; 3级, 叶片萎蔫, 主根和须根颜色均发褐。具体如图1所示。计算病情指数[15]。
植株发病率是病害调查时抗性鉴定的重要指标。根据幼苗根部褐色及叶片萎蔫程度进行人工评价和分级。抗性分级按国际标准分成4个等级:高抗, 病情指数< 20; 中抗, 病情指数21~50; 低抗, 病情指数51~80; 感病, 病情指数81~100。利用Excel软件对发病率、病情指数和抗性评价等级进行整理统计。
联苯胺染色法DAB(diaminobenzidine)是常用的抗病评价指标, 可检测病原菌诱导后H2O2的积累水平。植物被病原菌侵染后, 自身防御系统启动, 初期会产生大量活性氧(ROS), 其主要成分为H2O2; 在过氧化物酶作用下, DAB可与H2O2结合形成红褐色聚合物。
DAB染液的配置。10 mM Tris-HCl 9 mL、3%(m/V) CoCl2 1 mL、DAB, 显色时加入H2O2 5~10 mL混匀后立即使用。具体操作方法为:将接种枯萎病菌5 d的西瓜幼苗整株浸入1 mg· mL-1 DAB染液中, 25 ℃及光照下放置2 h, 然后转至95%乙醇中煮沸15 min, 对幼苗进行充分脱色, 观察植株各部位是否出现红褐色, 并进行观察拍照、抗性评价。
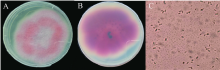
由图2可见, 将西瓜尖孢镰刀杆菌2号生理小种的病菌接种到PDA固体培养基中, 培养10 d后, 菌落颜色由中心至边缘变为紫红色。在显微镜下观察发现, 分生孢子为无色, 单孢为卵圆或杆状。
采用浸根法对西瓜5 d苗龄的幼苗进行枯萎病菌接种, 5 d后调查发病情况。结合病情指数对10份西瓜种质的枯萎病抗性进行评价。表1显示, 10份西瓜种质材料的抗性存在较大差异, 发病率19.9%~98.5%, 病情指数16.7~94.4。其中, 对西瓜枯萎病2号生理小种表现高抗的材料为1份(Ford hook), 发病率19.9%, 病情指数16.7; 表现为中抗的材料有3份, 包括PI288317、PI368509、PI536457, 发病率29.1%~44.9%, 病情指数38.9~41.7; 表现为低抗的材料有4个, 包括PI279460、PI278038、Sun sweet、冬瓜皮, 发病率67.7%~79.2%, 病情指数69.4~75.0; 表现为感病的材料有2个, 为广二和庆久, 发病率分别为96.3%和98.5%, 病情指数分别是91.8和94.4。
| 表1 幼苗接种西瓜枯萎病抗性鉴定结果 |
ROS迸发是植物应答病原菌的早期防卫反应之一。当病原菌入侵植物时, 会引起ROS迸发, 加速体内ROS的积累[16]。研究表明, ROS的代谢与植物的抗病性有关, 即ROS参与了植物与病原物互作体系中的许多关键过程, 包括抗菌作用[17]、细胞壁强化[18]、植保素合成[19]、抗病信号传导[20]和过敏性细胞死亡[21]等。利用DAB染色并通过褐色沉积反应可检测植物体内ROS的积累情况, 在一定程度上反映品种的抗病性。本研究对接种5 d后的西瓜幼苗进行DAB染色, 来验证本研究鉴定方法的结果。结果发现, 不同植株的褐色沉积程度与其枯萎病抗性呈负相关。由图3可知, 抗病材料Ford hook的植株褐色沉积最浅, 感病材料广二和庆久的植株褐色沉积最深。以上结果表明, 西瓜品种对枯萎病的抗性越强, 其DAB染色颜色越浅; 反之, 西瓜品种对枯萎病的抗性越弱, 其DAB染色颜色越深。DAB染色的结果与胚根接种结合人工鉴定的结果相吻合, 说明本研究建立的西瓜枯萎病抗性的胚根接种鉴定方法切实可行。
为使育种工作者能够快速准确的筛选到抗病材料, 以便进行后续研究, 枯萎病抗性鉴定是西瓜抗病育种的关键环节。本研究在传统浸根法的基础上加以改良, 对10份西瓜种质材料进行胚根接种, 鉴定出1个高抗种质(Ford hook)和3个中抗的西瓜种质(PI288317、PI368509、PI536457), 为选育抗病、优质的西瓜品种提供了材料基础。
(责任编辑:张瑞麟)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|